
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示);A与C形成CA3型分子,分子中C原子的杂化类型为 , 分子的立体结构为;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式; A2D由液态形成晶体时密度(填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA , 则该晶体的密度为g/cm3(用含a、NA的符号表示). 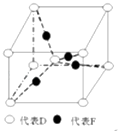
【答案】
(1)3d54s1
(2)C<O<N;sp3;三角锥形;![]() ;减小;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小
;减小;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小
(3)Cu2O;![]()
【解析】解:在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,B的一种核素在考古时常用来鉴定一些文物的年代,则B为碳元素,D原子核外电子有8种不同的运动状态,则D为氧元素,C的氧化物是导致酸雨的主要物质之一,且C的原子序数小于D,所以C为氮元素,E的基态原子在前四周期元素的基态原子中单电子数最多,其原子外围电子排布式为1s22s22p63s23p63d54s1 , 则E为铬元素,F元素的基态原子最外能层只有一个电子,其它能层均已充满,则F原子外围电子排布为3d104s1 , 所以F为铜元素,A与其余五种元素既不同周期也不同主族,所以A为氢元素.
(1.)E为铬元素,基态E原子的价电子排布为3d54s1 , 所以答案是:3d54s1;
(2.)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N;A与C形成NH3分子,分子中N原子形成3个N﹣H、含有1对孤对电子,故N原子杂化类型为sp3 , 分子的立体结构为三角锥形;C的单质为N2 , 化合物CO是等电子体,二者结构相似,CO分子中C原子与O原子之间形成三对共用电子对,故CO的电子式为 ![]() ;H2O形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小,所以答案是:C<O<N;sp3;三角锥形;
;H2O形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小,所以答案是:C<O<N;sp3;三角锥形; ![]() ;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小;
;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小;
(3.)根据晶胞的结构图可知,晶胞中含有氧原子数为1+8× ![]() =2,铜原子数为4,所以该化合物的化学式为Cu2O,晶胞质量为(4×
=2,铜原子数为4,所以该化合物的化学式为Cu2O,晶胞质量为(4× ![]() +2×
+2× ![]() )g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为
)g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为 ![]() cm,所以体积为(
cm,所以体积为( ![]() cm)3cm3 , 该晶体的密度为(4×
cm)3cm3 , 该晶体的密度为(4× ![]() +2×
+2× ![]() )g÷(
)g÷( ![]() cm)3=
cm)3= ![]() g/cm3 , 所以答案是:Cu2O;
g/cm3 , 所以答案是:Cu2O; ![]() .
.


科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素基态原子电子排布式为[Ar]3d104s2 , 它在元素周期表中的位置是( )
A.第3周期ⅡB族
B.第4周期ⅡB族
C.第4周期ⅦB族
D.第4周期Ⅷ族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫醉钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S203)可由亚硫酸钠和硫粉通过化合反应制得,装置如图I所示.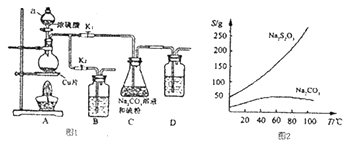
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O35H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装且气密性的操作是_ .
步骤2:加人药品,打开K1、关闭K2、加热.装置B、D中的药品可选用下列物质中的(填编号).
A.NaOH溶液 B.浓H2SO4C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的最逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 .
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加人足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时Cr42﹣全部转化为Cr2O72﹣;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010molL﹣1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O.I2+2S2O32﹣═S4O62﹣+2I﹣ , 则该废水中Ba2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将符合反应类型的选项字母填在横线上:
A.Fe3O4+4CO![]() 3Fe+4CO2
3Fe+4CO2
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
D.CaCO3+2HCl![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
E.C2H5OH(酒精)+3O2![]() 2CO2+3H2O
2CO2+3H2O
F.3Fe+2O2![]() Fe3O4
Fe3O4
G.CuO+H2![]() Cu+H2O
Cu+H2O
H.HCl+NaOH![]() H2O+NaCl
H2O+NaCl
(1)属于化合反应的有________;
(2)属于分解反应的有________;
(3)属于复分解反应的有________;
(4)属于置换反应的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( ) 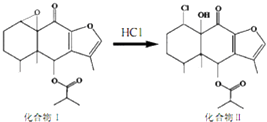
A.化合物I分子式为C19H24O5
B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,每种物质都能被氧化又能被还原的是( )
A.F2、Cl2、CuSO4B.Cl2、Al、H2C.H2S、HCl、H2O2D.F2、K、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mg NaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。请回答下列问题:
①步骤(1)中A仪器最好用__________(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
②能否用水代替苯_______,理由是______________________。
③NaCl晶体中,Na+和Cl-是按一定方式有规则均匀排列的,可以看作一系列立方体在空间的延伸。已知立方体的边长为acm,它拥有b个钠离子和b个氯离子,用上述测定方法测得的阿伏加德罗常数NA的表达式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com