
氟氧酸是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O=HOF+HF。该反应中水的作用与下列反应中水的作用相同的是
A.钠与水反应制氢气
B.过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸
D.氟单质与水反应制氧气
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:实验题
回归、改进、拓展教材实验,是高考化学实验考查的常见形式。
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究。基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理。
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式__________________________________。
(2)①该催化剂中铁元素的化合价为 。
②下图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是 。

II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
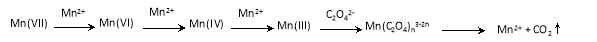
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+ 对该反应有催化作用
假设3:K+ 对该反应有催化作用
【设计、完成实验】
(3)称取 g草酸晶体(H2C2O4·2H2O),配制500 mL 0.10 mol/L H2C2O4溶液。在上述过程中必须用到的2种定量仪器是托盘天平和
(4)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
仔细阅读分析表中数据,回答问题:
x = mL,假设__________成立(填“1” 、“2”或“3”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高一下期末化学试卷(解析版) 题型:选择题
下列关于碱金属的叙述正确的是 ( )
A. 随着核电荷数增加,它们的密度逐渐减小
B. 随着核电荷数增加,单质的熔点、沸点升高
C. 随着核电荷数的增加,单质与水反应的剧烈程度增大
D. 随着核电荷数增加,离子的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西藏民族学院附中高一下期末化学试卷(解析版) 题型:填空题
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂。
(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______________.
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是_____(填字母)
A.最高正化合价:P>C
B.同温同浓度的两溶液的酸性:H3PO4>H2CO3
C.沸点:PH3>CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去);
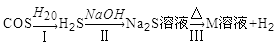
①已知:常温下,反应Ⅱ中每吸收1.7g H2S气体,反应放出热烈4.76kJ,则该反应的热化学方程式为_______________________________。
②已知M溶液中硫元素的主要存在形式为S2O32—,则反应Ⅲ中生成S2O32—的离子方程式为_______________.
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图像分析可知,a点时M溶液中除S2O32—外,还有______________(填含硫微粒的离子符号)。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西藏民族学院附中高一下期末化学试卷(解析版) 题型:选择题
下列各组物质中性质的变化规律排列正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4>H4SiO4
B. 稳定性:HI>HBr>HCl>HF
C. 微粒半径:Al3+>Mg2+>Na+>F-
D. 碱性:Ca(OH)2>KOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高二下期末化学试卷(解析版) 题型:填空题
请按要求回答下列问题。
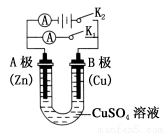
(1)①打开K2,合并K1。A电极可观察到的现象是_____________;B极的电极反应式为________________。
②打开K1,合并K2。A电极可观察到的现象是____________;B极的电极反应为________________________。
(2)判断原电池的正负极时,不仅要看金属活泼性顺序,还要注意此金属在电解质溶液中的活泼性。试回答下列问题:将铝片和铜片用导线连接,若插入浓硝酸中形成原电池,负极是 ,若插入氢氧化钠溶液中形成原电池,负极是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高二下期末化学试卷(解析版) 题型:选择题
某原电池装置如图所示。下列有关叙述中,正确的是 ( )
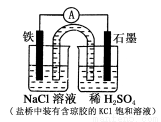
A.Fe作正极,发生氧化反应
B.负极反应:2H++2e-===H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一下期末化学试卷(解析版) 题型:选择题
下列关于烃的性质描述中正确的是
A.实验室可用H2除去乙烷中的乙烯
B.在催化剂作用下,苯与溴水反应生成溴苯,发生了反应
C.乙烯结构中含有碳碳双键,苯中不含碳碳双键,但二者均可发生加成反应
D.C2H6与Cl2发生取代反应,C2H4 与HCl发生加成反应,均可得到纯净的C2H5Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com