
 2NO2(g) ��H��+52.70 kJ��mol��1��
2NO2(g) ��H��+52.70 kJ��mol��1�� 2NO2(g)��ƽ�ⳣ��K= �����������ڼ���ͨ������N2O4����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ������)���ٴδﵽƽ���NO2��������� ԭƽ��ʱNO2���������(����ڡ�����С�ڡ����ڡ�)��
2NO2(g)��ƽ�ⳣ��K= �����������ڼ���ͨ������N2O4����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ������)���ٴδﵽƽ���NO2��������� ԭƽ��ʱNO2���������(����ڡ�����С�ڡ����ڡ�)�� N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)�����������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ����������� ��
N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)�����������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ����������� ��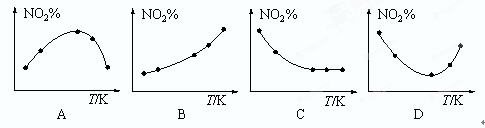
 �����ڷ�Ӧ��������ﶼֻ��һ�֣������ټ���N2O4�൱��������ѹǿ��ƽ�����淴Ӧ�����ƶ�������ƽ��ʱNO2�����������С��
�����ڷ�Ӧ��������ﶼֻ��һ�֣������ټ���N2O4�൱��������ѹǿ��ƽ�����淴Ӧ�����ƶ�������ƽ��ʱNO2�����������С��

 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB����)����H����QkJ/mol�����¶Ⱥ�ѹǿ�ı�ʱn��AB)�ı仯����ͼ������������ȷ����
2AB����)����H����QkJ/mol�����¶Ⱥ�ѹǿ�ı�ʱn��AB)�ı仯����ͼ������������ȷ����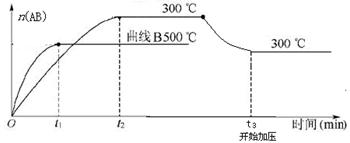
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Fe(s)+CO2(g) ��H="a" kJ/mol��a >0�������¶���K=0.263�������йظ÷�Ӧ��˵����ȷ����
Fe(s)+CO2(g) ��H="a" kJ/mol��a >0�������¶���K=0.263�������йظ÷�Ӧ��˵����ȷ����| A��������1 mol Fe�������յ�����С��a kJ |
| B���������¶ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ�������ѧƽ�������ƶ� |
| C����������ѹǿ����ʱ��仯��������жϸ÷�Ӧ�Ѵﵽ��ѧƽ��״̬ |
| D���ﵽ��ѧƽ��״̬ʱ����c(CO)="0.100" mol/L����c(CO2)="0.0263" mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3��g������H= ��92��4 KJ��mol��1������500�桢20 MPaʱ����N2��H2����һ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����Ӧ�����и����ʵ����ʵ����仯��ͼ��
2NH3��g������H= ��92��4 KJ��mol��1������500�桢20 MPaʱ����N2��H2����һ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����Ӧ�����и����ʵ����ʵ����仯��ͼ��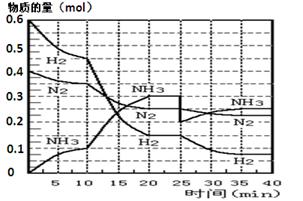
| A�����˴��� | B����С������� | C�������¶� | D������NH3���ʵ��� |
 2NH3��g�� +
2NH3��g�� + 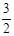 O2��g�� ����H =" a" kJ��mol��1
O2��g�� ����H =" a" kJ��mol��1| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4��8 | 5��9 | 6��0 |
 2NH3��g�� ��H= ��92 ��4kJ��mol��1
2NH3��g�� ��H= ��92 ��4kJ��mol��1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| ������� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�����仯 | ||
| X2 | Y2 | XY3 | ||
| �� | 0.1 | 0.3 | 0 | 4.63 kJ |
| �� | 0.8 | 2.4 | 0.4 | Q(Q>O)kJ |
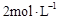
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
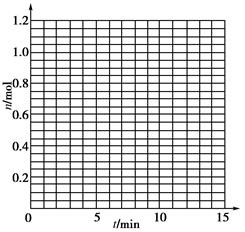
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ?2SO3(g)�����ﵽƽ�⣬����������У���ʼ�ձ���������䣬��ʼ�ձ���ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת����
?2SO3(g)�����ﵽƽ�⣬����������У���ʼ�ձ���������䣬��ʼ�ձ���ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת����| A������p% | B������p% | C��С��p% | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2CrO42-��2H�������ظ���أ�K2Cr2O7������ˮ���ϡ��Һ�ʳ�ɫ��
2CrO42-��2H�������ظ���أ�K2Cr2O7������ˮ���ϡ��Һ�ʳ�ɫ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com