
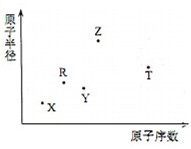
 ����������Ԫ��X��Y��Z��R��T��ԭ�Ӱ뾶��ԭ��������ϵ��ͼ��ʾ��Rԭ�������������ǵ��Ӳ�����2����Y��Z���γ�Z2Y��Z2Y2�����ӻ����Z��T�γɵĻ�����Z2T�������ƶϴ�����ǣ�������
����������Ԫ��X��Y��Z��R��T��ԭ�Ӱ뾶��ԭ��������ϵ��ͼ��ʾ��Rԭ�������������ǵ��Ӳ�����2����Y��Z���γ�Z2Y��Z2Y2�����ӻ����Z��T�γɵĻ�����Z2T�������ƶϴ�����ǣ�������| A�� | �γɵļ����Ӱ뾶�Ĵ�С˳��ΪT��Y��Z | |
| B�� | Z2Y��Z2Y2�����еĻ�ѧ��������ͬ | |
| C�� | 0.005mol•L-1T������������Ӧˮ�����ˮ��ҺpH����2 | |
| D�� | Z2T��ˮ��Һ�Լ��ԣ���ˮ�ĵ����дٽ����� |
���� Rԭ�������������ǵ��Ӳ�����2��������ΪC��S������ͼʾԭ�Ӱ뾶��ԭ��������ϵ��֪RӦΪC��Y��Z���γ�Z2Y��Z2Y2�����ӻ����ӦΪNa2O��Na2O2����YΪO��ZΪNa��Z��T�γɵ�Z2T���������ƻ�ˮ�ĵ���ƽ�⣬TӦΪS��X��ԭ�Ӱ뾶��С��ԭ��������С��ӦΪHԪ�أ���϶�Ӧ���ʡ�������������Լ���ĿҪ������⣮
��� �⣺�����Ϸ�����֪XΪH��RΪC��YΪO��ZΪNa��TΪSԪ�أ�
A��S�����Ӻ�����3�����Ӳ㣬��O��Na�����Ӻ�����2�����Ӳ㣬������Ӳ���Խ�࣬���Ӱ뾶Խ���Һ˵����Խ�����Ӱ뾶ԽС�����γɵļ����Ӱ뾶�Ĵ�С˳��ΪT��Y��Z����A��ȷ��
B��Na2Oֻ�������Ӽ���Na2O2�������Ӽ����ۼ�����B����
C.0.005mol•L-1T������������Ӧˮ����Ϊ���ᣬˮ��Һ��������Ũ��Ϊ0.01mol/L����pH����2����C��ȷ��
D��Na2Sˮ��ʼ��ԣ��ɴٽ�ˮ�ĵ��룬��D��ȷ��
��ѡB��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã�Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬�ƶ�Ԫ���ǽ���Ĺؼ����Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  �Ƚ� Cl2��Fe3+��I2�������� | B�� |  ��ȡ Fe��OH��2 ��ȡ Fe��OH��2 | ||
| C�� | 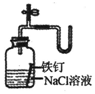 ֤��������ʱ�����μӷ�Ӧ | D�� | 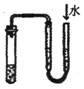 ���װ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ͨ��Ĥ��ؿɳ�ȥ��ˮ�е������ƺͶ��ȱ��ӣ�
ͨ��Ĥ��ؿɳ�ȥ��ˮ�е������ƺͶ��ȱ��ӣ� ������ԭ����ͼ��ʾ������˵����ȷ���ǣ�������
������ԭ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | BΪ��ص�������������ԭ��Ӧ | |
| B�� | ���������B���ص��߾�С��������A�� | |
| C�� | A���ĵ缫��ӦʽΪ +e-�TCl-+ +e-�TCl-+ | |
| D�� | �����·����0.2mole-ת��ʱ��A�������ӵ�H+����ĿΪ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������������ʪ�� | |
| B�� | ���������Һ����ˮ������ | |
| C�� | ��������ʳƷ���е������� | |
| D�� | Ũ�������ڼ������Ͱ����ܵ��Ƿ�©�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molH2ȼ�շų�������ΪH2��ȼ���� | |
| B�� | ij���ȷ�Ӧ���Է����У���˸÷�Ӧ��������Ӧ | |
| C�� | ��������Һ�еμ�Na2CO3��Һ����CO2�������� | |
| D�� | ԭ����з����ķ�Ӧ��ƽ��ʱ���õ�����е������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
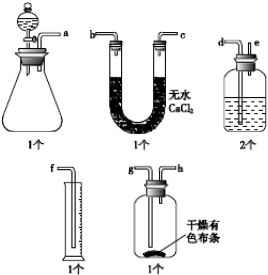
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
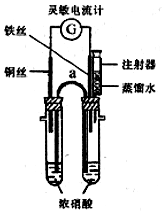 ij��ѧ����С���ͬѧ����ԭ���ԭ��̽��һ���¶��£�ʵ��ʱʵ�ʵĻ����¶ȣ�ʹ���ۻ�����������Ũ�ȣ�
ij��ѧ����С���ͬѧ����ԭ���ԭ��̽��һ���¶��£�ʵ��ʱʵ�ʵĻ����¶ȣ�ʹ���ۻ�����������Ũ�ȣ�| ʵ����� | ʵ���¶ȣ��棩 | ע��ˮ�������mL�� |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| �� | �� | �� | �� | ||
| �ܱ��������/L | 2 | 2 | 2 | 1 | |
| ��ʼ���ʵ��� | n��SO2��/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n��O2��/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2��ƽ��ת����/% | 80 | a1 | a2 | a3 | |
| A�� | ���¶��£��÷�Ӧ��ƽ�ⳣ��KΪ400 | |
| B�� | SO2��ƽ��ת���ʣ�a1��a2=a3 | |
| C�� | �ﵽƽ��ʱ���������е�����Ӧ���ʱ��������еĴ� | |
| D�� | �ﵽƽ��ʱ����������c�� SO3��������������c�� SO3�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com