
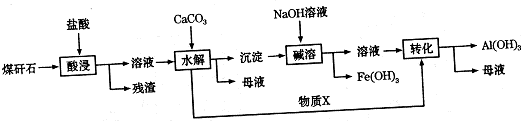
分析 含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)能和酸反应的物质有氧化铝和氧化铁;
(2)根据碳酸钙和溶液中的氢离子反应生成二氧化碳,过量二氧化碳通入偏铝酸钠溶液中反应生成氢氧化铝沉淀和碳酸氢钠,二氧化碳和碱反应生成碳酸氢根离子;
(3)加入CaCO3调节溶液的pH除去氢氧化铁;
(4)氯化铝溶液中水解显酸性,加入盐酸中氯化氢抑制氯化铝水解;
(5)氯化铝是共价化合物熔融时不能产生自由移动的离子,所以不能导电,电极材料选择惰性电极石墨,电极氧化铝制备铝,阳极是氧离子失电子发生氧化反应,生成的氧气会和电极材料碳发生反应.
解答 解:含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)氧化铝和氧化铁都能和盐酸反应生成盐和水,反应方程式分别是:Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O,
故答案为:Al2O3+6H+═2Al3++3H2O或Fe2O3+6H+═2Fe3++3H2O;
(2)氯化铝和氯化铁水解都生成盐酸,碳酸钙和盐酸反应生成氯化钙和二氧化碳,所以物质X是二氧化碳,过量二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸氢钠,过量的二氧化碳和碱反应生成碳酸氢盐,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,OH-+CO2=HCO3-;
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,OH-+CO2=HCO3-;
(3)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4,要使铁离子完全沉淀而铝离子不沉淀,则溶液的PH应该为3.2,过滤氢氧化铝沉淀时调节溶液pH为5.4,以使氢氧化铝完全沉淀,
故答案为:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3;
(4)氯化铝在溶液中存在溶解平衡,AlCl3•6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出;
故答案为:AlCl3饱和溶液中存在溶解平衡AlCl3•6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体;
(5)氯化铝是共价化合物熔融时不能产生自由移动的离子,所以不能导电,电极材料选择惰性电极石墨,电极熔融氧化铝制备铝,阳极是氧离子失电子发生氧化反应生成氧气,生成的氧气在高温下会和电极材料碳发生反应,电极损耗,需要定期更换;
故答案为:AlCl3是共价化合物,熔融时不能导电;石墨或碳;电极材料碳和电解过程中生成的氧气发生反应使电极损耗.
点评 本题以工艺流程为载体考查了溶解平衡原理、物质间的反应、除杂、电解原理分析判断、盐类水解的影响因素等知识点,这种题型是高考常考题型,综合性较强,涉及知识面较广,用教材基础知识采用知识迁移的方法分析解答,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | ||
| 丙 | 丁 | ||
| 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 丁和戊的原子核外电子数相差8 | |
| C. | 最高价氧化物对应的水化物的酸性:丙>丁 | |
| D. | 甲的单质在空气中燃烧生成只含共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水由液态变为玻璃态,体积缩小 | |
| B. | 水由液态变为玻璃态,体积膨胀 | |
| C. | 玻璃态是水的一种特殊状态晶体 | |
| D. | 玻璃态水是水分子在空间有规则排列形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
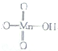 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的二元取代物无同分异构体 | B. | 苯的邻位二元取代物只有一种 | ||
| C. | 苯的间位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液与稀盐酸混合 | B. | 硫酸钠溶液与氯化钾溶液混合 | ||
| C. | 稀硫酸与氢氧化钠溶液混合 | D. | 氢氧化钠溶液与硫酸铜溶液混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com