
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
分析 (1)精确量取酸性溶液应该用酸式滴定管;根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂;通过观察溶液颜色变化判断终点,酚酞在酸性溶液中为无色,达到终点溶液稍显碱性,溶液变成浅红色;
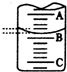
(2)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度为25,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;又因为滴定管下面没有刻度,所以此时滴定管中液体的体积应大于50.00-25.40=24.60ml;
(3)根据所用过程判断不当操作对相关物理量的影响;
(4)根据化学方程式CH3COOH+NaOH═CH3COONa+H2O计算醋酸的浓度.
解答 解:(1)向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管量取;醋酸与氢氧化钠反应生成了醋酸钠,醋酸钠属于强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂,故选酚酞;滴定时锥形瓶中为酸性溶液,酚酞在酸性溶液中为无色,达到终点溶液稍显碱性,变浅红色,则锥形瓶由无色变为浅红色且半分钟内不复原,说明达到滴定终点;
故答案为:酸式滴定管;酚酞;锥形瓶由无色变为浅红色且半分钟内不复原;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为25,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL,又因为滴定管下面没有刻度,所以此时滴定管中液体的体积应大于50.00-25.40=24.60ml
故答案为:25.40;大于24.60ml;
(3)A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积,液面偏高,读数偏小,导致NaOH溶液体积偏小,故A错误;
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定,反应不充分,导致NaOH溶液体积偏小,故B错误;
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,标准液被稀释,浓度偏小,导致NaOH溶液体积偏大,故C正确;
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,醋酸的物质的量偏大,导致NaOH溶液体积偏大,故D正确;
故选:CD;
(4)第一次数据相差较大,舍去,其余两次使用氢氧化钠溶液的平均体积=$\frac{25.35+25.30}{2}$mL,
CH3COOH+NaOH═CH3COONa+H2O
1 1
c(CH3COOH)×VmL cmo1/L×$\frac{25.35+25.30}{2}$mL
解得:c(CH3COOH)=$\frac{c×(25.35+25.30)}{2V}$mol/L;
故答案为:$\frac{c×(25.35+25.30)}{2V}$mol/L.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
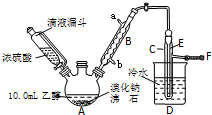 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测HCl溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中共转移0.4 mol电子 | B. | 原混合液中c(K+)为2.0 mol•L-l | ||
| C. | 电解得到的Cu的质量为6.4 g | D. | 电解后溶液中c(H+)为0.1 mol•L-l |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com