
| n |
| c |
| 8.4g |
| 84g/mol |
| 0.1mol |
| 0.1mol/L |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A、Ksp的大小与三种卤化银见光分解的难易无关 |
| B、将等体积的4×10-3mol?L-1的AgNO3溶液和4×10-3mol?L-1K2CrO4溶液混合,有Ag2CrO4沉淀产生 |
| C、向AgCl的悬浊液中滴加饱和Nal溶液可以得到黄色AgI悬浊液 |
| D、向100 mL 0.1mol?L-1的Na2SO4溶液中加入1 mL 0.1 mol?L-1的AgNO3溶液,有白 色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
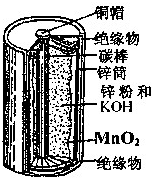
| A、MnO2是氧化剂,被氧化 |
| B、碳棒为负极、锌筒为正极 |
| C、放电过程中NH4+向锌极移动 |
| D、负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol/L的溶液 | X | Y | Z | W |
| PH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

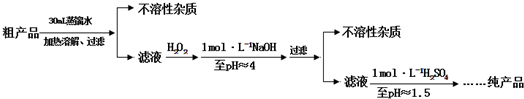

| 温 度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| CuSO4?5H2O | 23.1 | 32.0 | 46.4 | 61.8 | 83.8 |
| Cu(NO3)2?6H2O | 81.8 | 125.1 | |||
| Cu(NO3)2?3H2O | 160 | 178.5 | 208 |
查看答案和解析>>
科目:高中化学 来源: 题型:
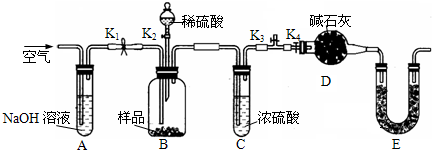
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46g NO2含有NA个NO2分子 |
| B、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
| C、标准状况下,NA个CO2分子所占的体积约为22.4 L |
| D、1mol Al3+离子含有的核外电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L二氯甲烷含有NA个二氯甲烷分子 |
| B、1L 0.1mol/L乙酸溶液中H+数为0.1NA |
| C、17.6g丙烷中所含的极性共价键为3.2NA个 |
| D、1mol Na2O2 固体中含离子总数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com