
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。
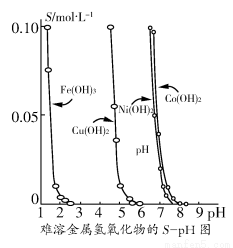
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
物质 | PbS | HgS | ZnS |
Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
(1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小 (4)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O (5)B
【解析】由图可知,在pH=3时溶液中不会出现Cu(OH)2沉淀。
(2)要除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右。
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,不能通过调控pH而达到分离的目的。
(4)Cu(OH)2(s) Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使三种杂质离子转化为更难溶解的金属硫化物沉淀,同时又不会引入其他离子。


科目:高中化学 来源:2014年高考化学苏教版总复习5-3微粒间相互作用力与物质多样性练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.N2、CS2、H2O、CH4都是非极性分子
B.SiO2、CsCl、HCl、HF四种晶体的熔点逐渐降低
C.CO2、PCl3、CCl4、CH4四种分子中,各原子都满足最外层8电子结构
D.由原子序数为1和8、1和6的元素,可分别形成原子数之比为1:1的化合物
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:填空题
(1)1 mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L(标准状况)氢气,则A分子中必有一个 基,若此基在碳链的一端,且A中无支链,则A的结构简式为 。
(2)A与浓硫酸共热,分子内脱去1分子水,生成B,B的结构简式为 ;B通入溴水中能发生 反应,生成C,C的结构简式为 。
(3)A在铜作催化剂时,与氧气在加热条件下发生氧化还原反应生成D,D的结构简式为 。
写出下列指定反应的化学方程式:
①A→B ;
②B→C ;
③A→D 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
有A、B、C三种气态烃组成的混合物共x mol,与足量氧气混合点燃完全燃烧后恢复原状况(标准状况)时,气体体积减少了2x mol,则3种烃可能为( )
A.CH4、C2H6、C3H8 B.CH4、C2H4、C3H4
C.C2H4、C2H2、CH4 D.C2H6、C3H4、C2H4
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
下列反应属于加成反应的是( )
A.C3H8+Cl2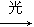 C3H7Cl+HCl
C3H7Cl+HCl
B.2FeCl2+Cl2=2FeCl3
C.CH2=CH2+H2O CH3CH2OH
CH3CH2OH
D.CH3CH2OH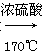 CH2=CH2↑+H2O
CH2=CH2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是( )
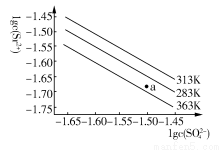
A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32—+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32—=CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3 B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确的是 ( )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+)
B.稀释醋酸溶液,溶液中所有离子的浓度均降低
C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-)
D.0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
T°C时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
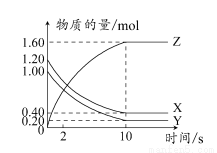
下列描述正确的是( )
A.平衡时,X、Y的转化率相同
B.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动
C.T°C时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40
D.T°C时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率约为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com