
W、X、Y、Z均为短周期元素,原子序数依次增大,且原子核外最外层电子数分别为5、6、2、6。 下列说法正确的是
A.最简单氢化物的还原性:X<Z
B.单质的沸点:W>Z
C.原子半径:Z>Y>X>W
D.X、Y、Z不可能存在于同一离子化合物中
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山西省忻州市高一上入学化学试卷(解析版) 题型:选择题
将一定量的铁粉加入到一定量的硝酸银和硝酸镁的混合液中,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则在滤渣中
A.一定有银、铁和镁 B.仅有银和铁
C.可能含镁 D.只有银
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
在C(s)+CO2(g)  2CO(g)反应可使反应速率增大的措施是
2CO(g)反应可使反应速率增大的措施是
①增大压强 ②增加碳的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2
A.①③⑤ B.②④ C.①③ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2016届广东省等三校高三上学期12月联考理综化学试卷(解析版) 题型:填空题
工业上回收利用某合金废料(主要含Fe、Cu、Al、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19。pH=7.3时Li+或Co3+开始沉淀。
(1)金属M为 。
(2)①加入H2O2的作用是(用离子方程式表示) 。
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1) 。需调节溶液pH范围为 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
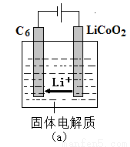
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a)。电池反应为LixC6+Li1-xCoO2 C6+LiCoO2,
C6+LiCoO2,
写出该电池放电时的负极反应式___________________________。
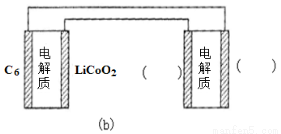
②锂硫电池的总反应为:2Li+S Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极( )中填写“Li”或“S”,以达到给锂硫电池充电的目的。
Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极( )中填写“Li”或“S”,以达到给锂硫电池充电的目的。
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上12月联考理综化学试卷(解析版) 题型:推断题
一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
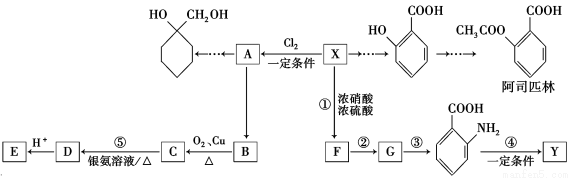
已知:
①X为芳香烃,其相对分子质量为92
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:
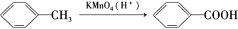
③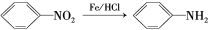 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为______________,其侧链氢原子全部被苯环取代后,最多有 个碳原子共面;(2) 的名称为____________________,G中官能团名称为___________;
的名称为____________________,G中官能团名称为___________;
(3)反应③的反应类型是________;已知A为一氯代物,则E的结构简式是____________;[来源:Z&xx&k.Co(4)反应④的化学方程式为__________________________________________;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有________种:
①含有苯环;
②既不能发生水解反应,也不能发生银镜反应;
③1 mol该有机物能与2 molNaHCO3完全反应。
(6)参照上述合成路线,结合所学知识,设计一条以A为原料制备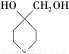 的合成路线(无机试剂任用)。合成路线流程图示例如下:
的合成路线(无机试剂任用)。合成路线流程图示例如下:
 。
。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第四次月考化学试卷(解析版) 题型:填空题
(Ⅰ)某温度下,NaCl溶液中的c(H+)=2.0×10-7 mol/L,则此时在溶液中:
(1)由水电离产生的c(OH-)= ;
(2)若温度不变,滴入稀硫酸使c(H+)=5.0×10-6 mol/L,则c(OH-)= 。
(Ⅱ)(3)某温度下水的离子积为KW =1×10-13,则该温度(填“大于”、“等于”或“小于”)
25℃。
若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(4)若所得混合液为中性,则a∶b= ;
(5)若所得混合液的pH=2,则a∶b= ;
(6)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,若测定结果偏高,其原因可能是 。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第四次月考化学试卷(解析版) 题型:选择题
将1 mol SO2和1 mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
A.等于0.3 mol B.等于0.15 mol
C.小于0.15 mol D.大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第四次月考化学试卷(解析版) 题型:选择题
实验报告中,以下数据合理的是
A.用碱式滴定管量取25.03mLH2SO4溶液
B.用50mL量筒量取21.48mL稀硫酸
C.用托盘天平称取11.7gNaCl
D.用pH试纸测定HNO3溶液的pH=3.7
查看答案和解析>>
科目:高中化学 来源:2016届湖南省郴州市高三上学期12月教学质量监测理综化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2C1-
B.向NaHCO3溶液中加入NaOH溶液:HC03一+OH-=C032-+ H20
C.向Ba(OH)2溶液中加入稀H2S04:Ba2++ OH-+ H++ S042-=BaS04 ↓+H20
D.向Cu粉中加入过量的浓HN03:Cu+4H++ 2N03-=Cu2++ 2N02 +2H20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com