
【小题1】 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:
| A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质 |
| C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质 |
| D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。 |
【小题1】ABCD
【小题2】①b>a>c ②b>a=c ③c>a=c ④a=b>c
【小题3】 ①1:1 ②11:9
解析【小题1】醋酸的浓度是0.1mol/L,若其pH大于1,氢离子浓度小于0.1mol/L,则说明醋酸没有完全电离,存在电离平衡,A可以。因为电离是吸热的,升高温度,pH变小,溶液酸性增强,说明醋酸在溶液中存在电离平衡,加热促进了醋酸的电离,B可以。若醋酸是强酸,则0.01 mol/L和0.10 mol/L的CH3COOH溶液中的pH相差1个单位,如果两者的pH相差小于1个单位,则证明存在电离平衡,C可以。酸越弱,则相应的钠盐就越容易水解,溶液的碱性就越强。所以如果醋酸钠溶液的pH大于7,则证明醋酸一定是弱酸,D正确。
【小题2】①硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,所以当其物质的量浓度相同时,c(H+)由大到小的顺序是硫酸>盐酸>醋酸。
②当三种酸的体积和浓度相同时,硫酸提供的氢离子的物质的量最多,盐酸和醋酸的一样多。所以它们消耗的氢氧化钠的物质的量是硫酸>盐酸=醋酸。
③当c(H+)相同、体积相同时,盐酸和硫酸中的氢离子是相同的,生成的氢气相同。由于醋酸的浓度大于盐酸的,所以最终醋酸生成的氢气多,即硫酸=盐酸<醋酸。④强酸稀释10倍,则溶液中氢离子的浓度将变为原来的1/10。由于醋酸是弱酸,在稀释过程中会促进醋酸的电离,因此最终溶液中氢离子的浓度将小于原来的1/10。所以pH盐酸和硫酸的pH相同,都大于醋酸的pH。
【小题3】考查pH的计算。硫酸和氢氧化钠混合,首先发生中和反应,生成硫酸钠和水。①若所得混合液为中性,则氢离子的物质的量和OH-的物质的量相同,即aL×0.1mol/L=bL×0.1mol/L,解得a:b=1:1。
②若所得混合液的pH=2,则说明硫酸是过量的。反应后的溶液中氢离子的浓度是0.01mol/L,则有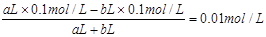 ,解得a:b=11:9。
,解得a:b=11:9。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com