
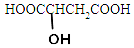 ,与该羟基酸含相同官能团的同分异构体有( )
,与该羟基酸含相同官能团的同分异构体有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2O | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
查看答案和解析>>
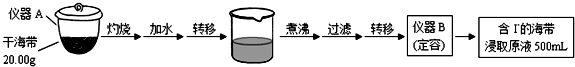
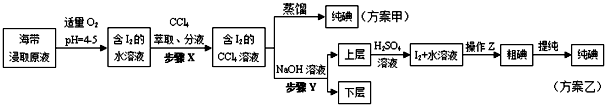
科目:高中化学 来源: 题型:实验题
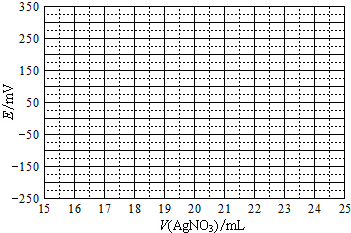
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学只研究自然界中存在的物质 | |
| B. | 化学的特征是认识分子和制造分子 | |
| C. | 通过化学方法可以制造出使人长生不老的“仙丹” | |
| D. | 化学的研究层面越来越广,原子核的变化也已成为化学研究的范畴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
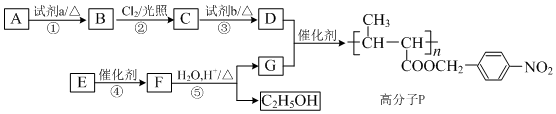
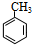 ,
,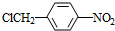 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$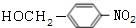 +NaCl.
+NaCl.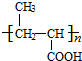 .
.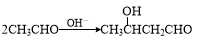
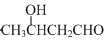 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
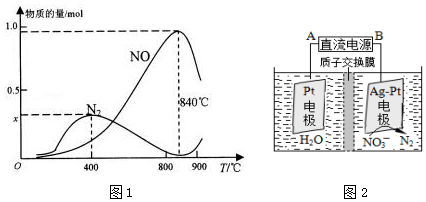
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液与盐酸反应生成氯化银 | |
| B. | 镁条与氯化铵溶液反应生成氢气 | |
| C. | 盐酸与碳酸钙反生成二氧化碳 | |
| D. | 硫酸铝溶液和小苏打溶液反应生成二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com