
| A、明矾和氯气均可用于水的消毒、杀菌 |
| B、地沟油不能食用,但可以在循环经济中发挥作用 |
| C、硬铝属于合金材料,餐桌上的瓷盘属于硅酸盐制品 |
| D、不需要通过化学反应就能从海水中获得食盐和淡水 |


科目:高中化学 来源: 题型:
| A、甲、乙、丙属同系物,均可与氯气发生取代反应 |
| B、甲的分子中所有碳原子在同一直线上 |
| C、甲、乙、丙中,丙的沸点最低 |
| D、丙有3种不同沸点的二氯取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 关于下列各图的叙述不正确的是( )
关于下列各图的叙述不正确的是( )| 表 丙 | |
| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2=2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.045mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表丙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24g NaH中阴离子所含电子总数为NA |
| B、1mol苯分子中含有3NA个碳碳单键 |
| C、NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| D、在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
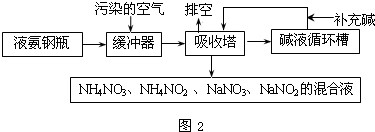
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质都是由同种元素组成的,只含一种元素的物质一定是纯净物 |
| B、金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气 |
| C、中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 |
| D、氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
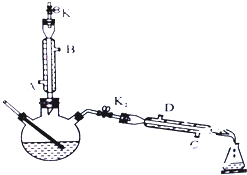 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com