
| A.测pH值 | B.测导电性大小 | C.测密度 | D.进行中和滴定 |
科目:高中化学 来源:不详 题型:填空题
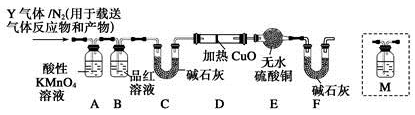
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
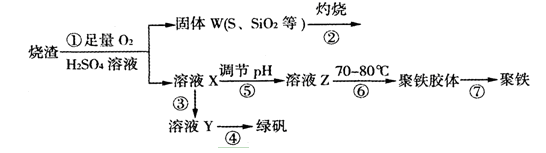
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
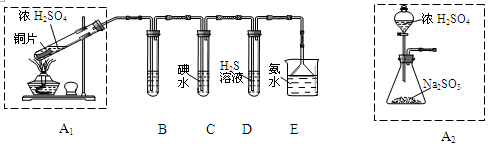
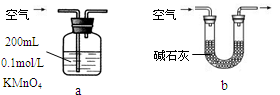
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸与亚硫酸钠反应制取二氧化硫,体现浓硫酸具有强氧化性 |
| B.铵盐受热易分解,均有NH3产生 |
| C.浓硝酸保存在棕色的细口瓶中 |
| D.化工厂可通过加高烟囱排放废气,防止形成酸雨 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
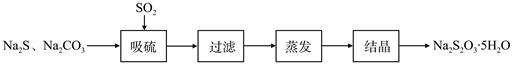
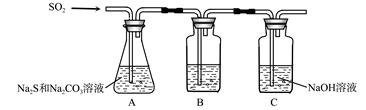
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
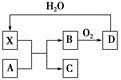
| A.X使蔗糖变黑的现象主要体现了X的脱水性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生 |
| D.工业上,B转化为D的反应条件为高温、高压、使用催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
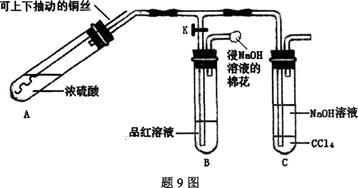
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | | | |
| 方案② | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com