
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
分析 利用三段式可求得平衡时各成分的浓度,结合公式v(NH3)=$\frac{△c}{△t}$,进而求得反应速率.
解答 解:利用三段式
N2 +3H2 ?2NH3
起始量(mol/L) $\frac{3.6mol}{2L}$ $\frac{10.8mol}{2L}$ 0
变化量(mol/L) 1mol/L 3mol/L 2mol/L
2min量(mol/L) 0.8mol/L 2.4mol/L 2mol/L
则在这10min内NH3的平均反应速率是v(NH3)=$\frac{△c}{△t}$=$\frac{2mol/L}{10min}$=0.2mol/(L•min),
故选B.
点评 本题考查化学反应速率计算,把握化学反应速率计算公式及运用好三段式的计算方法是解答关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
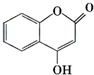 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: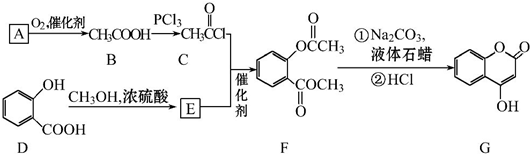
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ② | 向新制得的Na 2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
| ⑥ | 向AlCl 3溶液中滴加NaOH溶液至过量 |
| 实验序号 | 实验步骤(略) | 实验现象 | 化学方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ | |||
| ⑤ | |||
| ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
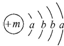 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.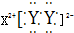

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>H2O>苯 | |
| C. | 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与Cl2取代 | B. | 乙烯与Cl2加成 | ||
| C. | 乙炔与HCl加成 | D. | 乙醇与浓盐酸取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下为液体 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 可自身加成形成聚乙烯 | D. | 能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | F | |||
| 3 | G | H | I | J | K | L | M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com