
【题目】某化合物的分子式为![]() ,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为
,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为![]() 和
和![]() ,已知
,已知![]() 分子的键角为
分子的键角为![]() 。下列推断不正确的是
。下列推断不正确的是 ![]()
![]()
A.![]() 分子的空间构型为V形
分子的空间构型为V形
B.![]() 键为极性共价键,
键为极性共价键,![]() 分子为非极性分子
分子为非极性分子
C.![]() 分子中A原子采取
分子中A原子采取![]() 杂化
杂化
D.![]() 分子中无H原子,分子间不能形成氢键
分子中无H原子,分子间不能形成氢键
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用![]() 表示,下列叙述正确的是
表示,下列叙述正确的是![]()
①![]() 含有电子数为
含有电子数为![]()
②![]() 中含有的
中含有的![]() 键总数目为
键总数目为![]()
③![]()
![]() 与
与![]() 完全反应时转移电子数为
完全反应时转移电子数为![]()
④![]() 硅晶体中含有
硅晶体中含有![]() 个
个![]() 键
键
⑤![]() 通入足量氢氧化钠溶液中充分反应,转移的电子数等于
通入足量氢氧化钠溶液中充分反应,转移的电子数等于![]()
⑥![]() ,
,![]()
![]() 溶液中,
溶液中,![]() 和
和![]() 离子数的总和是
离子数的总和是![]()
⑦在常温常压下,![]() 铁与
铁与![]()
![]() 充分反应,转移的电子数为
充分反应,转移的电子数为![]()
⑧![]() 和
和![]() 的混合物共
的混合物共![]() ,其中所含原子数一定为
,其中所含原子数一定为![]() .
.
A.①②③⑤⑧B.②④⑥⑦⑧C.①③⑤⑥⑦D.①②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为_____。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为____。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
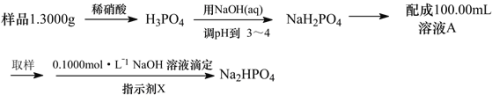
①NaOH标准溶液应盛放在如图所示的滴定管___(选填“甲”或“乙”)中。

②滴定时所用的指示剂X可为____,判断滴定终点的方法是___。
③下列操作会导致测定结果偏低的是____
A.碱式滴定管未润洗
B.锥形瓶用待测液润洗
C.读取标准液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.元素的第一电离能越大,其金属性越强
B.原子核外的 M层上的 s能级和 p能级都填满了电子,而 d轨道上尚未排有电子的两种原子,其对应元素不一定位于同一周期
C.元素电负性越大的原子,失电子能力越强
D.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的各组元素![]() 从左到右
从左到右![]() 同时满足下列三个条件的是 ( )
同时满足下列三个条件的是 ( )
a.原子半径依次减小;b.第一电离能逐渐升高;c.电负性逐渐增大。
A.Na、Mg、AlB.C、O、N C. Li、Na、KD.I、Cl、F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
(B中试剂为浓盐酸、碳酸钠溶液、硅酸钠溶液)
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ![]()
![]()
A.主族元素的电负性越大,元素原子的第一电离能一定越大
B.在形成化合物时,电负性越小的元素越容易显负价
C.在元素周期表中,处于非金属三角区边缘的元素常被成称半金属
D.在元素周期表中,元素的原子半径从左到右逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
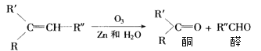
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种B. 4种C. 5种D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3![]() K2S4+3KI。装置(2)为电解池的示意图。当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
K2S4+3KI。装置(2)为电解池的示意图。当闭合开关K时,X附近溶液先变红,下列说法正确的是( )

A.K+从右到左通过离子交换膜
B.电极M的反应式:I3﹣+2e﹣=3I﹣
C.电极X的反应式:4OH﹣﹣4e﹣═O2↑+2H2O
D.当电极Y有0.2mole﹣转移时,产生0.1molCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com