
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
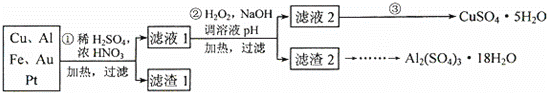
(1)第①步Cu与混酸反应的离子方程式为 .得到滤渣1的主要成分为 .
(2)第②步中加入H2O2的作用是 ,使用H2O2的优点是 ;调溶液pH的目的是 .
(3)简述第③步由滤液2得到CuSO4•5H2O的方法是 .
(4)由滤渣2制取Al2(SO4)3•18H2O,设计了以下三种方案:
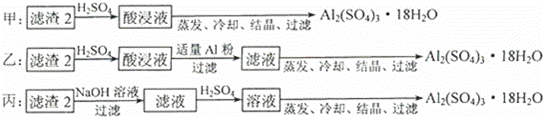
上述三种方案中, 方案不可行,原因是 ;从原子利用率角度考虑, 方案更合理.
(5)用滴定法测定CuSO4•5H2O含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用
c mol/L EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:
Cu2++H2Y2﹣→CuY2﹣+2H+.写出计算CuSO4•5H2O质量分数的表达式ω= .
| 制备实验方案的设计;化学方程式的有关计算;物质分离和提纯的方法和基本操作综合应用.. | |
| 专题: | 实验设计题. |
| 分析: | (1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+; (2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝; (3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体; (4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断; (5)依据滴定实验和反应离子方程式计算得到. |
| 解答: | 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3﹣ 故答案为:Cu+4H++2NO3﹣ (2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜, 故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;使Fe3+、Al3+沉淀除去; (3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体; 故答案为:加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体; (4)制备硫酸铝晶体的甲、乙、丙三种方法中, 甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体; 丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费, 所以从原子利用率和是否产生杂质考虑知,乙更合理, 故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙. (5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L﹣1 EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+ 铜离子物质的量和标准液物质的量相同,则20mL溶液中铜离子的物质的量=cmol/L×b×10﹣3L=bc×10﹣3mol; 则ag样品中CuSO4•5H2O的质量=c×b×10﹣3mol×250g/mol×5,所以CuSO4•5H2O质量分数的表达式= 故答案为: |
| 点评: | 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目大. |


科目:高中化学 来源: 题型:
下列说法正确的是(NA表示阿伏加德罗常数)( )
A.在常温常压下,11.2 升氯气含有的分子数为0.5NA
B.在常温常压下,1摩尔气体含有的原子数为NA
C.32 g氧气所含原子数目为2NA
D.在同温同压下,相同体积的任何气体单质所含原子数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 |
|
| B. | 向硅酸钠溶液中滴加盐酸,有白色凝胶生成 |
|
| C. | 向AlCl3溶液中逐滴滴加氨水至过量,先出现白色沉淀后溶解 |
|
| D. | 工业上可以电解氯化镁溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项表达中正确的是( )
|
| A. | Na2O2的电子式为 |
|
| B. | 106g的乙醇和丙醇混合液完全燃烧生成的CO2为112 L(标准状况) |
|
| C. | 在氮原子中,质子数为7而中子数不一定为7 |
|
| D. | Cl﹣的结构示意图为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaCl固体配制0.1 mol·L-1的NaCl溶液,下列操作或说法正确的是
A.若在移液过程中,溶液溅出容量瓶,则应重新配制溶液
B.将5.85gNaCl固体溶于1 L水中可配成0.1 mol·L-1的NaCl溶液
C.固体直接转移到容量瓶中,并加水稀释到刻度线
D.称量时,将固体NaCl直接放在天平左盘上
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式
A.浓盐酸与铁屑反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B.Cl2通入水中:Cl2 + H2O = 2H++ Cl-+ ClO-
C.往稀硫酸中滴入氢氧化钡溶液:Ba2++SO42-=BaSO4↓
D.实验室制备二氧化碳气体: 2H+ + CaCO3 ═ Ca2+ + CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应原理及其应用,不正确的是( )
A.苯与浓硝酸反应;制备TNT炸药
B.葡萄糖能与新制Cu(OH)2悬浊液反应;尿糖检测
C.醋酸能与CaCO3、Mg(OH)2等反应;用食醋除去暖瓶中的水垢
D.乙烯能与水反应生成乙醇;制取工业酒精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com