
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
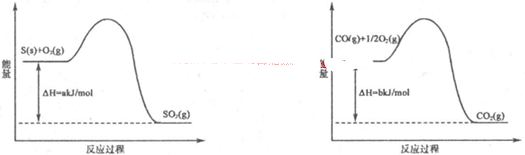
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。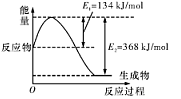
已知: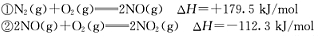
请写出NO与CO反应生成无污染气体的热化学方
程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。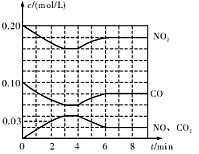
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温’’、“降温’’)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。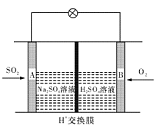
(1)2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-759.8kJ/mol;(2分)
(2)①c (2分) ②0.015 (2分)③升温 (2分)④1/36 (2分) 逆向(2分)
(3)SO2+ 2H2O-2e-=SO42-+4H+ (2分) 0.5 (2分)
解析试题分析:(1)由图知298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO 的热化学方程式为NO2(g)+CO(g)=NO(g) +CO2(g)△H=-234kJ/mol ③;NO与CO反应生成无污染气体是氮气和二氧化碳气体,根据盖斯定律得②-①+2×③即为所求,所以答案是2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-759.8kJ/mol;
(2)①NO2(g)+CO(g)=NO(g) +CO2(g),该反应为反应前后气体物质的量不变的可逆反应,压强始终不变,a错误;b、体积不变,NO的物质的量增加,浓度增大,平衡逆向移动,K不变,错误;c、升高温度后,平衡逆向移动,K减小,N02的转化率减小,正确;d、充入氦气,容器体积不变,所以反应物的浓度不变,平衡不移动,错误答选c;
②在0~2 min内NO的浓度增加0.03mol/L,所以v(NO)="0.03mol/L/2min=0.015" mol·L-1·min-1
③第4 min时反应物浓度增大,生成物浓度减小,说明平衡逆向移动,所以是升温;
④6min时各物质的平衡浓度分别为c(NO2)="0.18" mol·L-1,c(CO)="0.08" mol·L-1,c(NO)=c(CO2)="0.02" mol·L-1,所以K= c(NO)·c(CO2)/c(NO2)·c(CO)=1/36;此时再向容器中充人CO、NO各0.060 mol,则c(NO)·c(CO2)/c(NO2)·c(CO)>1/36,所以平衡逆向移动;
(3)二氧化硫在负极通入,发生氧化反应,电极反应式为SO2+ 2H2O-2e-=SO42-+4H+,当有0.25molSO2被吸收时,转移电子的物质的量是0.5mol,根据得失电子守恒,正极发生O2+4e-+4H+=2H2O,则通过质子(H+)交换膜的H+的物质的量为0.5mol。
考点:考查热化学方程式和盖斯定律的计算应用,化学平衡的移动,化学平衡常数的计算,电化学原理理解分析


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
.(17分)减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。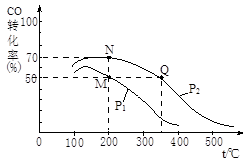
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性
明显增强。则该反应离子方程式为 。
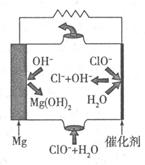
②电化学降解NO 的原理如图所示,电源正极为 (填“a”或“b”);
的原理如图所示,电源正极为 (填“a”或“b”);
若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为 。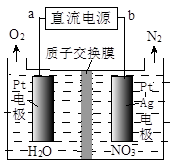
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)  2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某反应A(g)+B(g)??C(g)+D(g)过程中的能量变化如图所示,回答问题。
该反应是 (填“吸热”或“放热”)反应,该反应的ΔH= kJ/mol(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量 (填“一定高”“一定低”或“高低不一定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+O2
2NH3+O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
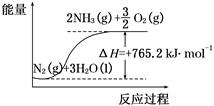
(2)已知: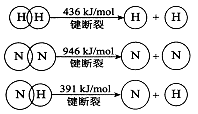
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。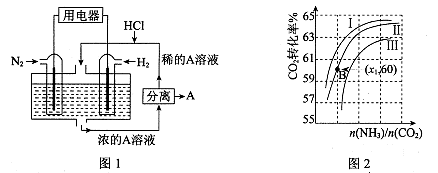
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比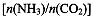 、水碳比
、水碳比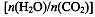 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料时的相对投资费用和能量消耗的数据。
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J·t-1 | 28×109 | 38×109 | 48×109 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 _________________________。
(2)已知H2O(l) H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
___________________________________。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH="+67.7" kJ·mol-1
2NO2(g) ΔH="+67.7" kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
肼和二氧化氮反应的热化学方程式为 __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。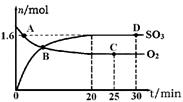
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com