
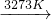 Si(粗)+2CO↑.
Si(粗)+2CO↑.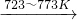 SiCl4(l);SiCl4+2H2
SiCl4(l);SiCl4+2H2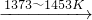 Si(纯)+4HCl
Si(纯)+4HCl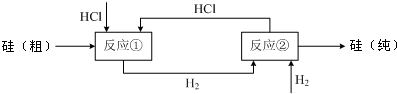
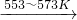 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)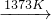 Si(纯)+3HCl
Si(纯)+3HCl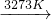 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑,
SiC+2CO↑, ,补充的HCl为
,补充的HCl为 -3mol=1mol,
-3mol=1mol, -1mol=0.25mol,故需补充投入HCl和H2的物质的量之比是1:0.25=4:1,
-1mol=0.25mol,故需补充投入HCl和H2的物质的量之比是1:0.25=4:1,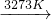 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑及硅和碳化硅的物质的量之比为1:1,计算出参加反应的C 和SiO2的质量比;
SiC+2CO↑及硅和碳化硅的物质的量之比为1:1,计算出参加反应的C 和SiO2的质量比;

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:多选题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com