
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | NaOH晶体中既含有离子键又含有共价键 | |
| D. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
分析 A.干冰为二氧化碳,不属于电解质;
B.根据分散质颗粒大小将分散系分为溶液、浊液和胶;
C.钠离子和氢氧根离子以离子键结合,氢氧根离子中氧和H以共价键结合;
D.氧化铝为两性氧化物.
解答 解:A.液态氯化氢为电解质,而干冰不属于电解质,故A错误;
B.根据分散质颗粒大小将分散系分为溶液、浊液和胶体,丁达尔效应是胶体的性质,故B错误;
C.钠离子和氢氧根离子以离子键结合,氢氧根离子中O和H共价键结合,故C正确;
D.Na2O、Fe2O3为碱性氧化物,氧化铝为两性氧化物,故D错误;
故选C.
点评 本题考查较为综合,涉及分散系的分类依据、碱性氧化物判断、电解质与非电解质等知识,题目难度不大,注意氧化铝属于两性氧化物,为易错点,试题培养了学生的分析能力就灵活应用能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1mol/L氯化钠溶液 | B. | 5 mL 2mol/L 氯化铵溶液 | ||
| C. | 150 mL 1mol/L氯化钾溶液 | D. | 75 mL 1.5mol/L 氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
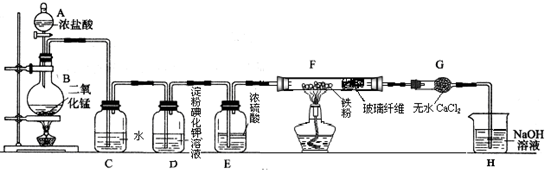
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | B. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | C. | c(H+)•c(OH-) | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
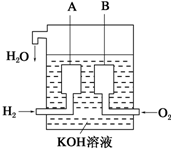 (1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:
(1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com