
 Č«ÓÅ漵䵄ŌŖ¼ģ²ā¾ķ¼°¹éĄą×Üø“Ļ°ĻµĮŠ“š°ø
Č«ÓÅ漵䵄ŌŖ¼ģ²ā¾ķ¼°¹éĄą×Üø“Ļ°ĻµĮŠ“š°ø ʷѧĖ«ÓžķĻµĮŠ“š°ø
ʷѧĖ«ÓžķĻµĮŠ“š°ø Š”ѧʌĩ³å“Ģ100·ÖĻµĮŠ“š°ø
Š”ѧʌĩ³å“Ģ100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
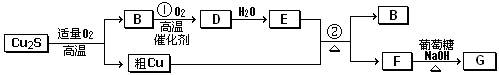
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 ĖŲ£¬ĘäŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£W”¢YµÄŃõ»ÆĪļŹĒµ¼ÖĀĖįÓźµÄÖ÷ŅŖĪļÖŹ£¬XµÄ»łĢ¬Ō×ÓŗĖĶāÓŠ7øöŌ×Ó¹ģµĄĢī³äĮĖµē×Ó£¬ZÄÜŠĪ³ÉŗģÉ«£Ø»ņשŗģÉ«£©µÄ
ĖŲ£¬ĘäŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£W”¢YµÄŃõ»ÆĪļŹĒµ¼ÖĀĖįÓźµÄÖ÷ŅŖĪļÖŹ£¬XµÄ»łĢ¬Ō×ÓŗĖĶāÓŠ7øöŌ×Ó¹ģµĄĢī³äĮĖµē×Ó£¬ZÄÜŠĪ³ÉŗģÉ«£Ø»ņשŗģÉ«£©µÄ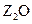 ŗĶŗŚÉ«µÄZOĮ½ÖÖŃõ»ÆĪļ”£
ŗĶŗŚÉ«µÄZOĮ½ÖÖŃõ»ÆĪļ”£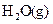 __________£ØĢī”°Ēæ”±»ņ”°Čõ”±£©”£
__________£ØĢī”°Ēæ”±»ņ”°Čõ”±£©”£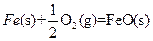
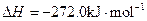

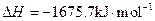
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā
 05 mol/LµÄNaOHČÜŅŗ£¬ĻņĮķŅ»·ŻČÜŅŗÖŠµĪ¼Ó0.600 mol/LBa(NO3)2ČÜŅŗ£¬Į½ČÜŅŗÖŠ¾łÉś³É³Įµķ£¬ĒŅ³ĮµķµÄÖŹĮæĖęĖł¼ÓČÜ
05 mol/LµÄNaOHČÜŅŗ£¬ĻņĮķŅ»·ŻČÜŅŗÖŠµĪ¼Ó0.600 mol/LBa(NO3)2ČÜŅŗ£¬Į½ČÜŅŗÖŠ¾łÉś³É³Įµķ£¬ĒŅ³ĮµķµÄÖŹĮæĖęĖł¼ÓČÜ ŅŗµÄĢå»ż±ä»ÆČēĻĀĶ¼ĖłŹ¾£ŗ
ŅŗµÄĢå»ż±ä»ÆČēĻĀĶ¼ĖłŹ¾£ŗ
 £¬³ä·Ö·“Ó¦ŗó£¬ŌŚ±ź×¼×“æöĻĀÉś³ÉNOµÄĢå»żÓėŹ£Óą½šŹōµÄÖŹĮæ¼ūĻĀ±ķ£ØÉčĻõĖįµÄ»¹Ō²śĪļÖ»ÓŠNO£©£ŗ
£¬³ä·Ö·“Ó¦ŗó£¬ŌŚ±ź×¼×“æöĻĀÉś³ÉNOµÄĢå»żÓėŹ£Óą½šŹōµÄÖŹĮæ¼ūĻĀ±ķ£ØÉčĻõĖįµÄ»¹Ō²śĪļÖ»ÓŠNO£©£ŗ| ŹµŃ鱹ŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü |
| Ļ”ĻõĖįĢå»ż/mL | 100 | 200 | 300 | 400 |
| Ź£Óą½šŹōÖŹĮæ/g | 9.0 | 4.8 | 0 | 0 |
| NOĢå»ż/L | 1.12 | 2.24 | 3.36 | V |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®0.15mol/L | B£®0.3mol/L | C£®0.225mol/L | D£®ĪŽ·Ø¼ĘĖć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®65 ”Ć56 | B£®56 ”Ć108 |
| C£®56 ”Ć9 | D£®65 ”Ć9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
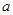 gĮņĖįĶČÜŅŗ
gĮņĖįĶČÜŅŗ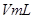 £¬½«ČÜŅŗÕō·¢µō
£¬½«ČÜŅŗÕō·¢µō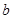 gĖ®ŗó»Öø“µ½20”ćC£¬Ē”ŗĆČ«²æÉś³ÉĮņĖįĶ¾§Ģå
gĖ®ŗó»Öø“µ½20”ćC£¬Ē”ŗĆČ«²æÉś³ÉĮņĖįĶ¾§Ģå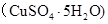 £¬ŌņĻĀĮŠ¹ŲĻµŹ½“ķĪóµÄŹĒ
£¬ŌņĻĀĮŠ¹ŲĻµŹ½“ķĪóµÄŹĒA£®ŌĮņĖįĶČÜŅŗµÄĆܶČĪŖ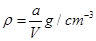 |
B£®ŌĮņĖįĶČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ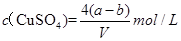 |
C£®ŌĮņĖįĶČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżĪŖ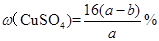 |
D£®Éś³ÉĮņĖįĶ¾§ĢåµÄĪļÖŹµÄĮæĪŖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ČōĪŽĶĪö³ö£¬ČÜŅŗÖŠÓŠCu2+”¢Fe2+ŗĶFe3+Ąė×Ó |
| B£®ČōĪŽĶĪö³ö£¬ČÜŅŗÖŠÓŠCu2+ŗĶFe2+Ąė×Ó£¬Ņ²æÉÄÜÓŠFe3+Ąė×Ó |
| C£®ČōÓŠĶĪö³ö£¬ČÜŅŗÖŠÓŠFe2+Ąė×Ó£¬Ć»ÓŠCu2+ŗĶFe3+Ąė×Ó |
| D£®ČōÓŠĶĪö³ö£¬ČÜŅŗÖŠÓŠFe2+Ąė×Ó£¬æÉÄÜÓŠCu2+Ąė×Ó£¬Ņ²æÉÄÜÓŠFe3+Ąė×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®NO3£ | B£®Fe3£« | C£®SO42£ | D£®Mg2£« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
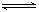 Al(OH)4- + H+ ¢ŚNH3+H2O
Al(OH)4- + H+ ¢ŚNH3+H2O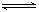 NH4+ + OH_
NH4+ + OH_²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com