
【题目】以有机物A合成聚酯类高分子化合物F的路线如下图所示:

已知:①RCH=CH2 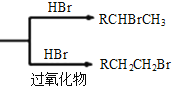 ②丙酮能被KMnO4(H+)氧化,使之褪色
②丙酮能被KMnO4(H+)氧化,使之褪色
(1)A生成B的反应类型为_______,C中含氧官能团的名称为_______。
(2)G是与CH3OH相对分子质量相差56的同系物,且不能使KMnO4(H+)褪色,G的名称为__________________
(3)检验A分子碳碳双键的方法_______________________________________________。
(4)D与NaOH水溶液反应的化学方程式为_____________________________________。
(5)E在一定条件下还可以合成含有六元环结构的H,则H的结构简式为____________。
(6)若F的平均相对分子质量为25200,则其平均聚合度为_______________
(7)满足下列条件的C的同分异构体有____________种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制氢氧化铜悬浊液反应产生2mol砖红色沉淀
(8)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物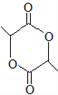 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示:![]() 目标产物。__________________
目标产物。__________________
【答案】 氧化反应 酯基 2-甲基-2-丁醇 取少量A,加入足量新制Cu(OH)2悬浊液,加热充分反应;取实验后试管中的清液少许,向其中加入稀硫酸酸化,再加入KMnO4溶液(或溴水),KMnO4溶液(或溴水)褪色,说明A中含碳碳双键 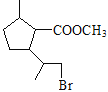 +2NaOH
+2NaOH![]()
 +CH3OH+NaBr
+CH3OH+NaBr 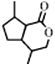 150 12种
150 12种 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
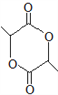
【解析】分析:根据B→C的试剂和条件以及C的结构简式,可逆推出B的结构简式为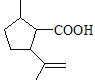 ;根据题给已知①,C与HBr在过氧化物作用下发生加成反应生成的D的结构简式为
;根据题给已知①,C与HBr在过氧化物作用下发生加成反应生成的D的结构简式为 ;D与NaOH水溶液、加热发生水解反应,产物酸化后生成的E的结构简式为
;D与NaOH水溶液、加热发生水解反应,产物酸化后生成的E的结构简式为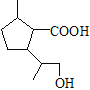 ;E中含羧基和羟基,E发生缩聚反应生成聚酯类高分子化合物F,F的结构简式为
;E中含羧基和羟基,E发生缩聚反应生成聚酯类高分子化合物F,F的结构简式为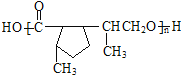 。
。
详解:根据B→C的试剂和条件以及C的结构简式,可逆推出B的结构简式为 ;根据题给已知①,C与HBr在过氧化物作用下发生加成反应生成的D的结构简式为
;根据题给已知①,C与HBr在过氧化物作用下发生加成反应生成的D的结构简式为 ;D与NaOH水溶液、加热发生水解反应,产物酸化后生成的E的结构简式为
;D与NaOH水溶液、加热发生水解反应,产物酸化后生成的E的结构简式为 ;E中含羧基和羟基,E发生缩聚反应生成聚酯类高分子化合物F,F的结构简式为
;E中含羧基和羟基,E发生缩聚反应生成聚酯类高分子化合物F,F的结构简式为 。
。
(1)对比A、B的结构简式,A→B是A中醛基氧化成B中羧基,A生成B的反应类型为氧化反应。根据C的结构简式,C中含氧官能团的名称为酯基。
(2)与CH3OH相对分子质量相差56的同系物为C5H11OH,G不能使KMnO4(H+)褪色,根据已知②“丙酮能被KMnO4(H+)氧化,使之褪色”以及醛类能使KMnO4(H+)褪色,G的结构简式为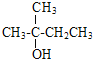 ,根据醇的系统命名原则,G的名称为2-甲基-2-丁醇。
,根据醇的系统命名原则,G的名称为2-甲基-2-丁醇。
(3)检验A中的碳碳双键可用溴水或酸性KMnO4溶液,由于A中的醛基也能使溴水或酸性KMnO4溶液褪色而干扰碳碳双键的检验,所以先用新制Cu(OH)2悬浊液或银氨溶液与醛基反应排除醛基的干扰。检验A分子碳碳双键的方法:取少量A,加入足量新制Cu(OH)2悬浊液,加热充分反应;取实验后试管中的清液少许,向其中加入稀硫酸酸化,再加入KMnO4溶液(或溴水),KMnO4溶液(或溴水)褪色,说明A中含碳碳双键。
(4)D的结构简式为 ,D与NaOH水溶液反应的化学方程式为
,D与NaOH水溶液反应的化学方程式为 +2NaOH
+2NaOH![]()
 +CH3OH+NaBr。
+CH3OH+NaBr。
(5)E的结构简式为 ,E中含羧基和羟基,E发生分子内酯化生成含有六元环结构的H,H的结构简式为
,E中含羧基和羟基,E发生分子内酯化生成含有六元环结构的H,H的结构简式为 。
。
(6)F的结构简式为 ,F的链节的式量为168,F的平均相对分子质量为25200,F的平均聚合度为
,F的链节的式量为168,F的平均相对分子质量为25200,F的平均聚合度为![]() =150。
=150。
(7)C的结构简式为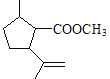 ,C的不饱和度为3,C的分子式为C11H18O2,1molC的同分异构体与新制Cu(OH)2悬浊液反应产生2mol砖红色沉淀,C的同分异构体中含2个醛基;C的同分异构体中含1个六元碳环,且环上相邻4个碳原子上各连有一个取代基;符合①②两个条件的C的同分异构体有:
,C的不饱和度为3,C的分子式为C11H18O2,1molC的同分异构体与新制Cu(OH)2悬浊液反应产生2mol砖红色沉淀,C的同分异构体中含2个醛基;C的同分异构体中含1个六元碳环,且环上相邻4个碳原子上各连有一个取代基;符合①②两个条件的C的同分异构体有: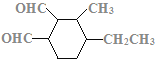 、
、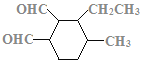 、
、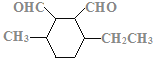 、
、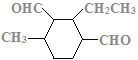 、
、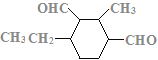 、
、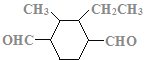 、
、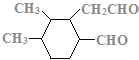 、
、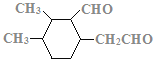 、
、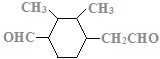 、
、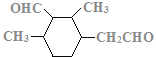 、
、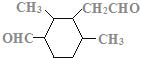 、
、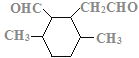 ,共12种。
,共12种。
(8) 中官能团为酯基,
中官能团为酯基, 由
由![]() 通过酯化反应生成;
通过酯化反应生成;![]() 与原料
与原料![]() 对比,碳干骨架不变,原料中醛基氧化成羧基、碳碳双键最终变为羟基,模仿A→B将
对比,碳干骨架不变,原料中醛基氧化成羧基、碳碳双键最终变为羟基,模仿A→B将![]() 氧化成
氧化成![]() ;根据已知①,
;根据已知①,![]() 与HBr发生加成反应生成
与HBr发生加成反应生成![]() ,
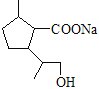
,![]() 水解后酸化生成
水解后酸化生成![]() ;合成路线为:
;合成路线为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
 。
。


科目:高中化学 来源: 题型:
【题目】氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是_____________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______________________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是___________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。
①55℃蒸发结晶; ②趁热过滤; ③___________;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是______;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是_________________;
②所称取的样品中NaClO2的物质的量为_______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:
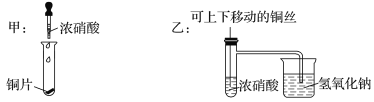
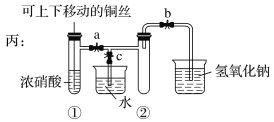
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是__________________________________。
(2)和甲装置相比,乙装置的优点是①______________________;②________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞________,再打开活塞________,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。请回答下列问题:
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为_______________________________
(2)二茂铁属于___________________晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为下图中的________________(选填“a”或“b”)
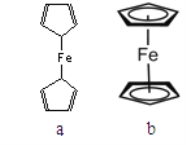
(3)环戊二烯(![]() )中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
)中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
(4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为______________。
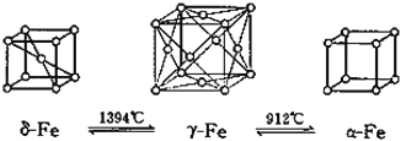
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是_______
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm-3,晶胞边长为4.28×10-10 m,则FexO中x=_____(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl晶体的晶胞如图,已知氯化钠的摩尔质量为M g·mol-1,晶体中最邻近的钠离子和氯离子中心间的距离为a cm,晶体的密度为b g·cm-3。则下列叙述正确的是 ( )

A.每个Na+周围最近且等距离的Cl-所围成的空间构型为正六面体
B.每个Na+周围最近且等距离的Na+有6个
C.阿伏加德罗常数NA的值可表示为![]()
D.阿伏加德罗常数NA的值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸的原料。氨经一系列反应可以得到硝酸,如图所示:
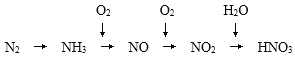
根据已知信息及所学知识回答下列问题:
(1)写出实验室制取氨气的化学方程式_____________;
(2)写出氨的催化氧化的化学方程式_____________;
(3)计算生成1.0mol HNO3需要_______molNH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com