
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、第IIA族和第VIA、第VIIA族元素之间易形成离子键,以此来解答.
解答 解:①Cl2中只含非极性共价键,为单质;
②Na2O2中含离子键和O-O非极性键,为离子化合物;
③NaOH中含离子键和O-H极性键,为离子化合物;
④HCl中含H-Cl极性键,为共价化合物;
⑤H2O2中含H-O极性键和O-O非极性键,为共价化合物;
⑥MgF2只含离子键,为离子化合物;
⑦NH4Cl中含离子键和N-H极性键,为离子化合物;
⑧CaCl2只含离子键,为离子化合物,
(1)属于离子化合物的是②③⑥⑦⑧,故答案为:②③⑥⑦⑧;
(2)属于共价化合物的是④⑤,故答案为:④⑤;
(3)含有离子键的物质是②③⑥⑦⑧,故答案为:②③⑥⑦⑧;
(4)既含有共价键又含有离子键的物质是②③⑦,故答案为:②③⑦.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:解答题
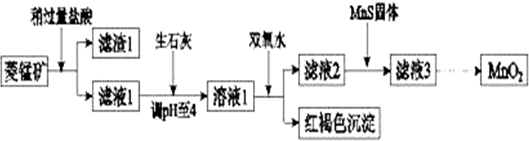
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )| A. | N4与N2互称为同位素 | |
| B. | N4属于一种新型的化合物 | |
| C. | N4化学性质比N2稳定 | |
| D. | 1mol N4气体转化为N2时要放出882kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 反应物的性质是决定反应速率快慢的主要因素 | |
| C. | 相同体积、不同浓度的盐酸分别与大小、形状都相同的铁片反应的速率:1 mol•L-1时<0.1 mol•L-1时 | |
| D. | 在不同温度时,鲜牛奶变酸的速率:28℃时>5℃时 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=7的NH4Cl和NH3•H2O混合溶液中,含有OH-的数目为10-7NA | |
| B. | 一定条件下6.4gSO2与足量氧气反应,转移的电子数为0.2NA | |
| C. | 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na-的浓度为2mol•L-1 | |
| D. | 46gC2H4O中含有的C-H键数目一定为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醇类在一定条件下都能发生消去反应生成烯烃 | |
| B. | CH3OH、CH3CH2OH、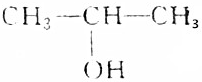 、 、 都能在铜催化下发生氧化反应 都能在铜催化下发生氧化反应 | |
| C. | 将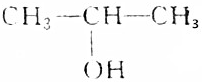 与CH3CH2OH在浓H2SO4存在下加热,最多可生成3种有机物 与CH3CH2OH在浓H2SO4存在下加热,最多可生成3种有机物 | |
| D. | 醇类在一定条件下都能与羧酸反应生成酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com