
| A. | 电子亚层(能级)是描述电子运动的电子云状态 | |
| B. | 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来 | |
| C. | 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数 | |
| D. | 电子云伸展方向与能量大小是无关的 |
分析 A.电子亚层(能级)是电子在核外空间出现概率密度分布的形象化描述;
B.电子的运动状态由电子层、电子亚层、电子云的伸展方向以及电子的自旋状态决定;
C.第一能层只有s能级1个原子轨道,第二能层有s和P能级共有4个原子轨道,第三能层有s、P和d能级共有9个原子轨道,与电子层、电子亚层、电子云的伸展方向及电子的自旋无关;
D.离原子核越远的电子,其能量越大.
解答 解:A.电子亚层(能级)是电子在核外空间出现概率密度分布的形象化描述即电子运动的电子云状态,故A正确;
B.电子的运动状态由电子层、电子亚层、电子云的伸展方向以及电子的自旋状态决定,所以在电子层、电子亚层、电子云的伸展方向、以及电子的自旋状态确定时,电子的运动状态才能确定下来,故B正确;
C.第一能层只有s能级1个原子轨道,第二能层有s和P能级共有4个原子轨道,第三能层有s、P和d能级共有9个原子轨道,与电子层、电子亚层、电子云的伸展方向及电子的自旋无关,故C错误;
D.离原子核越远的电子,其能量越大,则p原子轨道电子的平均能量随能层的增大而增加,所以电子云伸展方向与能量大小是无关,故D正确;
故选C.
点评 本题考查了核外电子的运动状态等知识点,注意电子云不是电子的运动轨迹是电子在核外空间出现概率密度分布的形象化描述,为易错点.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )| A. | 不慎将桶烯撒倒地面瓷砖上,可用火烤干 | |
| B. | 1mol桶烯在一定条件下能与3molCl2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯可用做其它有机涂料的溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中的官能团为羟基 | B. | 可由乙烯通过加成反应制取 | ||
| C. | 与丙三醇互为同系物 | D. | 通过取代反应可制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镭的金属性比钙弱 | B. | 单质能与水反应生成氢气 | ||
| C. | 在化合物中呈+2价 | D. | 碳酸镭难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 电解质为NH4Cl的锌锰干电池比电解质KOH锌锰干电池使用寿命长 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
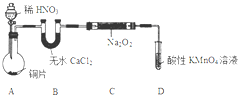 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NH4Cl饱和溶液中加入金属镁可以得到两种气体 | |
| B. | pH=12Ba(OH)2溶液中c(OH-)是0.001mol/LNaOH溶液c(OH-)的10倍 | |
| C. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的4倍,已知:KSP[Cd(OH)2]=7.2×10-15,Ksp[Co(OH)2]=1.8×10-15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com