
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
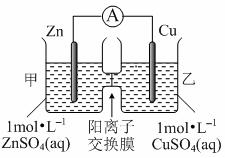
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:选择题
n L三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2n L,这三种烃不可能的组合是
A.CH4、C2H4、C3H4以任意比混合
B.C2H6、C4H6、C2H2以2:1:2的物质的量之比混合
C.C3H8、C4H8、C2H2以11:14:26的质量之比混合
D.CH4、C3H6、C2H2以a:b:b体积比混合
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(气) + Y2(气)  2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
A.Y2为0.2 mol/L B.Y2 为0.35 mol/L
C.X2 为0.2 mol/L D. Z为 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源:2016届西藏拉萨中学高三上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)氨是合成硝酸、铵盐和氮肥的基本原料,请问:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol•L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
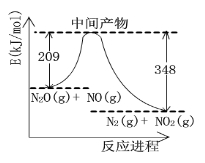
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示, 若生成1mol N2,其△H= kJ•mol-1。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质量监测化学试卷(解析版) 题型:选择题
原电池是将化学能转变为电能的装置。关于如图所示,原电池的说法正确的是

A.Cu为负极,Zn为正极
B.电子由铜片通过导线流向锌片
C.溶液中H+由正极流向负极
D.原电池的反应本质是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:填空题
原电池是化学对人类的一个重大贡献。
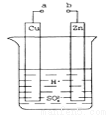
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生的离子方程式是_____________,
②a和b用导线连接,Cu极为原电池____________极(填“正”或“负”),Zn极发生__________(填“氧化”或“还原”)反应。
③Zn片上发生的电极反应:________________,Cu片上发生的电极反应:________________。
(2)若a和b相连接,导线上转移0.2mol电子时,理论上Zn片质量减轻___________g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:填空题
合成氨工业的核心反应是N2(g)+3H2(g) 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
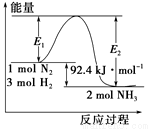
(1)该反应的ΔH=____________kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1的变化:E1__________(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量____________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)===P4O10(s) ΔH 1=-2983.2 kJ·mol-1
P(s,红磷)+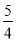 O2(g)===
O2(g)=== 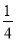 P4O10(s) ΔH 2=-738.5 kJ·mol-1
P4O10(s) ΔH 2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:实验题
(10分)高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、 、 。
②配制过程中玻璃棒所起的作用是 。
③下列操作对实验结果的影响偏大的是 (填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
①配平该反应的化学方程式:FeSO4 + KMnO4 + H2SO4  K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
②实验时应测定的数据有:量取FeSO4溶液的体积和 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省福安市高二上学期第一次月考化学试卷(解析版) 题型:选择题
在新制的氯水中加入少量的碳酸钠粉末,下列说法正确的是
A.pH减小,HClO浓度减小
B.pH减小,Cl-浓度增大
C.pH增大,Cl-浓度减小
D.pH增大,HClO浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com