
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
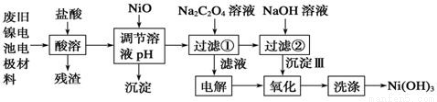
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。 H2O > NiC2O4
H2O > NiC2O4 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一
 Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一 Ni2O3+3 H2O
Ni2O3+3 H2O
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:选择题
下列有关叙述正确的是( )
A.因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同
B.在晶体中有阳离子就一定有阴离子
C.由于水分子间可以形成氢键故水分子的稳定性很强
D.在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.X的简单气态氢化物的热稳定性比W的弱
B.YX、ZX2、WX3中化学键的类型相同
C.W的最高价氧化物对应水化物的酸性比Z的弱
D.原子半径:rY >rZ >rW >rX
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一6月月考化学试卷(解析版) 题型:选择题
能用来鉴别乙醇、四氯化碳、己烷、己烯四种无色溶液的一种试剂是
A.金属钠 B.溴水 C.氢溴酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一6月月考化学试卷(解析版) 题型:选择题
下列物质中,不能和氯气发生取代反应的是
A.CH3Cl B.CCl4 C.CH2Cl2 D.CH4
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、R属于短周期主族元素.X的原子半径是短周期主族元素中最大的,Y 元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m﹣n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述错误的是
A.Y的氢化物的沸点比R的氢化物的沸点高
B.Z、W、R按最高价氧化物对应水化物的酸性强弱排列顺序是R>W>Z
C.X2Y2化合物中的化学键与X2R中的化学键类型完全相同
D.RY2通入Ba(NO3)2溶液中有白色沉淀生成,该沉淀不溶于硝酸
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三下仿真二理综化学试卷(解析版) 题型:填空题
氮的化合物在生产生活中广泛存在。
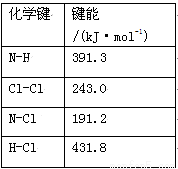
(1)①氯 胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况 如下表所示:
如下表所示:
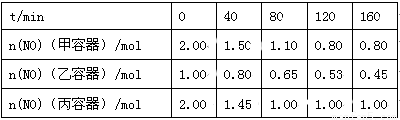
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺二理综化学试卷(解析版) 题型:选择题
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
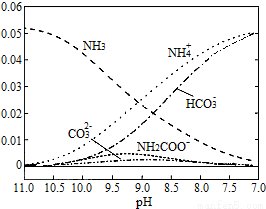
A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入, 不断增大
不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下第三次考试化学试卷(解析版) 题型:选择题
有关物质( 的叙述正确的是
的叙述正确的是
A.最多有5个碳原子在一条直线上 B.发生加聚反应的产物为:
C.所有碳原子可能在同一平面上 D.1 mol该物质最多能与3 mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com