
【题目】往装有![]() 的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
A.只有Fe2+和Fe3+B.只有Fe2+
C.一定有Fe2+、Cu2+,可能有Fe3+D.一定有Fe2+,可能有Cu2+
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】![]() 下,某反应达到平衡,平衡常数
下,某反应达到平衡,平衡常数![]() 恒容时,升高温度,NO浓度减小.下列说法正确的是
恒容时,升高温度,NO浓度减小.下列说法正确的是
A.该反应的焓变为正值
B.恒温下减小压强,反应体系的颜色加深
C.升高温度,逆反应速率减小
D.该反应化学方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO![]() N2+3H2O+3Cu,用下图所示装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C 中的固体是氧化铜。
N2+3H2O+3Cu,用下图所示装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C 中的固体是氧化铜。
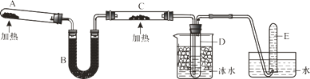
回答下列问题:
(1)A中发生反应的化学方程式是_____。
(2)B中加入的物质是_____。
(3)实验时在C中观察到的现象是_____,该反应中氨的作用是_____(填氧化剂或还原剂)。
(4)检验实验后试管D中物质的方法和现象是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
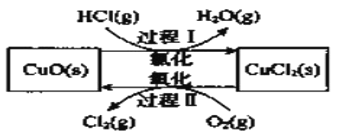
过程 I 的反应为, 2HCl(g)+CuO(s) ![]() CuCl2(s)+H2O(g)△H= -132kJ/mol
CuCl2(s)+H2O(g)△H= -132kJ/mol
(1)该原理中起到催化剂作用物质的化学式为_______________________;
(2)过程 II 反应的热化学方程式为____________________;
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。

①比较 a、b 两点的平衡常数大小 K(a)=_______________K(b)(填“>”“<”或“=”),解释原因为________________;
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2_________________p1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,各地媒体纷纷报道了有“火锅红”、“火锅飘香剂”、“辣椒精”等造就的“化学火锅”的新闻,食品添加剂的使用引起了人们的注意,亟待规范。
乙偶姻是一种应用较广泛的香料.乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,乙偶姻中含有碳氧双键.与乙偶姻有关的反应如下: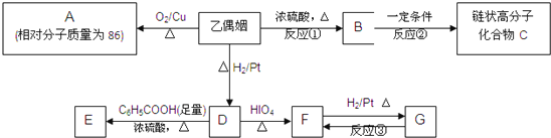
已知:HO﹣RCH﹣CHR’﹣OH![]() RCHO+R’CHO
RCHO+R’CHO
(1)乙偶姻的分子式为__,G的结构简式为__;
(2)反应①、②的反应类型为:①__、②__;
(3)D→E反应的化学方程式为________________;
B→C反应的化学方程式为___________________;
(4)X是乙偶姻的同分异构体,属于酯类,写出2种X可能的结构简式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是生产钛白的副产品,价格低,以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:
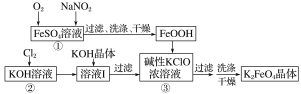
已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请回答下列问题:
(1)铁黄(FeOOH)中铁元素的化合价是________。写出反应①生成铁黄(FeOOH)的离子方程式:____________________________,在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)写出反应③的化学方程式:___________________________________________。
(3)K2FeO4可作为新型多功能水处理剂的原因是_____________________________。
(4)该工艺每消耗标准状况下112LCl2理论上得到________gK2FeO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。如图是某科研小组以含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程:
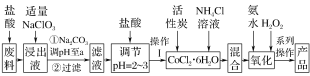
写出加“适量NaClO3”发生反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。
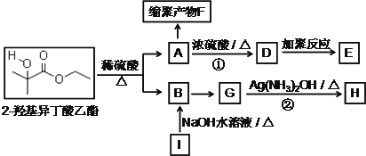
(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)![]() 2C(g),ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
2C(g),ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
![]()
A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时N的体积为2.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com