
 ;
;
分析 (1)质子数和中子数决定原子的种类;第三周期半径最小的元素Cl,则氯离子核外有3个电子层,最外层电子数为8,据此书写离子结构示意图;
(2)设备B的名称为接触式;设备A中发生的反应为硫化亚铁和氧气反应生成三氧化二铁和二氧化硫;
(3)简易量热计用于测量反应热;
(4)0.5mol甲醇放出363.2KJ热量,1mol甲醇弱酸放热726.4KJ,据此分析.
解答 解:(1)质子数和中子数决定原子的种类;第三周期半径最小的元素Cl,氯离子核外有3个电子层,最外层电子数为8,离子结构示意图为 ,
,
故答案为:质子数和中子数; ;
;
(2)设备B的名称为接触式;设备A中发生的反应为硫化亚铁和氧气反应生成三氧化二铁和二氧化硫,故化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:接触式;4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(3)简易量热计用于测量反应热,故用于测定盐酸和氢氧化钠溶液反应热的装置,此装置名称叫简易量热计,
故答案为:简易量热计;
(4)1mol甲醇弱酸放热726.4KJ,所以甲醇燃烧的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol.
点评 本题考查离子结构示意图、化学方程式的书写,以及热化学方程式的书写,本题难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O═H++OH- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHS═Na++HS- | D. | HCO3-═H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: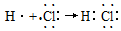 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去 | |
| C. | 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生 | |
| D. | 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中.
为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0~t1min内X与Y的平均反应速率之比为3:2 | |
| B. | t2时刻改变的条件可能是压强或催化剂 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 该反应中Z一定为产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com