
【题目】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
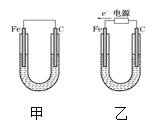
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___棒,乙装置中的____棒;
②乙装置的电化学防护法称为____,其中碳极的电极反应式是:_____。
③取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为___,发生反应的离子方程式为________
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______。
②甲装置碳极的电极反应属于_____(填“氧化反应”或“还原反应”);
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因_____
(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是(_____)
A.KI B.H2SO4 C.CuCl2 D.AgNO3
【答案】碳 铁 外加电流的阴极保护法 2H2O-4e-=O2↑+4H+ 产生蓝色沉淀 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 还原反应 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 B
Cl2↑+H2↑+2OH- 还原反应 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 B
【解析】
(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
②外加电源,铁在阴极,属于外加电流的阴极保护法,碳极是阳极,失电子发生氧化反应;
③用K3[Fe(CN)6]溶液检验亚铁离子。
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,正极上发生得电子的还原反应;
③氯气具有强氧化性,能将碘离子氧化生成碘单质,碘遇淀粉试液变蓝色。
(3)电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同,应为电解水型的电解,电解时阳极反应为:4OH--4e-=2H2O+O2↑,阴极反应为:4H++4e-=2H2↑,可为电解含氧酸溶液、强碱溶液或活泼金属的含氧酸盐溶液。
(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu;
②外加电源,铁在阴极,乙装置的电化学防护法称为外加电流的阴极保护法,碳极是阳极,根据放电顺序,水电离的OH-失电子发生氧化反应,碳极的电极反应式是:2H2O-4e-=O2↑+4H+。
③甲装置中Fe为负极,Fe失电子生成Fe2+,取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为产生蓝色沉淀,发生反应的离子方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓。
(2)①Fe为阴极,C为阳极,电解NaCl溶液生成NaOH、氢气、氯气,离子反应方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH- ;
Cl2↑+H2↑+2OH- ;
②甲中碳为正极,正极上氧气得电子发生还原反应,电极反应为2H2O+O2+4e-═4OH-;
③碳电极为阳极,阳极上Cl-失电子生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,故原因为:在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝。
(3)A.电解KI溶液,生成KOH、H2、I2,加水显然不能恢复电解前的状态,应通入适量的HI气体,故A错误。
B.电解硫酸,阳极生成氧气,阴极生成氢气,实际为电解水,电解后加入水可恢复到原来的浓度,故B正确;
C.电解CuCl2,阳极生成氯气,阴极生成Cu,实际为电解氯化铜本身,电解后加入氯化铜恢复到原来的浓度,故C错误;
D.电解AgNO3,阳极析出O2,阴极生成Ag,要使溶液恢复到原来的浓度,应加入Ag2O,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现据“三大酸”与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解,该反应的离子方程式为_。
(2)在一定体积的18mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol,则浓硫酸的实际体积__(填“大于”“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可向其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为__。
(3)根据如图操作及现象推断酸X为__(填序号)。

A.浓盐酸 B.浓硫酸 C.浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。
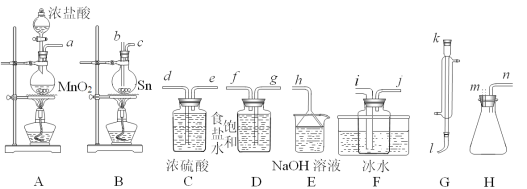
SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.从苯的结构简式![]() 看,苯分子中含有碳碳双键
看,苯分子中含有碳碳双键
B.苯的分子式为C6H6,它能使酸性KMnO4溶液褪色
C.![]() 的四氯代物有3种
的四氯代物有3种
D.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g)ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如图:

下列说法正确的是( )
A.过程Ⅰ、过程Ⅱ均为放热过程
B.图示显示:起始时的2个H2O都参与了反应
C.过程Ⅲ生成了极性键和非极性键
D.使用催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是很古老的一次性电池,它的生产原料主要有软锰矿和闪锌矿。科研人员开发了综合利用软锰矿和闪锌矿的同槽酸浸工艺,工艺流程如下图所示。

已知:软锰矿中含MnO2约66%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
请回答下列问题:
(1)反应I需不断搅拌,其目的是______________。
(2)反应I中主要的氧化还原反应化学方程式为______________。
(3)检验反应I滤液中Fe3+的试剂为____________________。反应III中MnO2的作用是______________。
(4)已知Ksp(ZnCO3)=1.4×10-10、Ksp(MnCO3)=2.2×10-11;要使反应IV之后的溶液中Zn2+、Mn2+浓度均降到1.0×10-6 mol·L-1,则溶液中残留的CO32-浓度至少为___mol·L-1。
(5)如图是Na2SO4和Na2SO410H2O的溶解度曲线
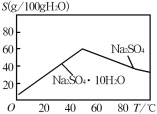
(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液蒸发结晶→_______→ 用乙醇洗涤→干燥。用乙醇洗涤而不用水洗的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
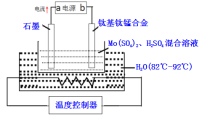
A.a极为电源的负极,发生氧化反应
B.电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2
C.钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+
D.电路中电子流向为:a极![]() 石墨,钛基钛锰电极
石墨,钛基钛锰电极![]() b极
b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于______(填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为____________,在CB3分子中C元素原子的原子轨道发生的是___________杂化。
(3)C的氢化物的空间构型为____________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是________________________。
(4)B元素的电负性_______D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明___________。
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为_______。(阿伏加德罗常数用NA表示)
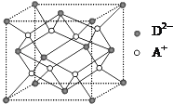
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com