
【题目】有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料。D与A位于同一主族,是构成地球上矿物质的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是 ;再向上述溶液中加入乙醇,有 ;原因是 ;
(4)A的氢化物比D的氢化物相比,熔点高是的 (填化学式),理由是
(5)下列说法正确的是( )
a.晶体析出规则是晶格能高的晶体最后析出
b.铜型和钾型都是密置层堆积方式
c.在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高
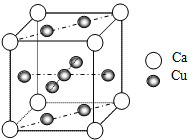
(6)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为_____________,已知两个最近的Ca原子之间的距离为apm,则该合金的密度为_____________g/cm3,(用含NA和a的代数式表示)。
【答案】(1)原子晶体;sp3;
(2)[Ar]3d104s24p5或1s22s22p63s23p63d104s24p5
(3)开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液;深蓝色晶体析出;[Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂;
(4)SiH4;CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低;
(5) c
(6)1:5;![]() 。
。
【解析】试题分析:有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,电子排布为1s22s22p2,为C元素;由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,为Br元素;C及其合金是人类最早使用的金属材料,为Cu元素;D与A位于同一主族,是构成地球上矿物质的主要元素,为Si元素。
(1)SiC属于原子晶体,晶体中C原子周围的Si原子呈四面体分布, Si原子周围的C原子也呈四面体分布,其中心原子是以sp3杂化成键,故答案为:原子晶体;sp3;
(2)Br元素是35号元素,核外电子排布式为, [Ar]3d104s24p5或1s22s22p63s23p63d104s24p5;
(3)向硫酸铜溶液中逐滴滴加氨水,可以观察到开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液;再向上述溶液中加入乙醇,[Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂;有深蓝色晶体析出,故答案为:开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液;深蓝色晶体析出;[Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂;
(4) CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低,故答案为:SiH4;CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低;
(5)a.溶解度小的先析出晶体,与晶格能的大小无关,故a错误;b.钾型的空间利用率为68%是非密置层堆积方式,铜型的空间利用率是72%是密置层堆积方式,故b错误;c.采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数为12,所以在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子,故c正确;d.能形成分子间氢键的物质沸点较高,邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,故d错误;故选c;
(6)晶胞中Ca位于定点,N(Ca)=8×![]() =1,Cu位于面心和体心,共有N(Cu)=8×
=1,Cu位于面心和体心,共有N(Cu)=8×![]() +1=5,则该合金中Ca和Cu的原子个数比为1:5;1mol晶体的质量为40+64×5=360g,1mol晶体含有NA个晶胞,因此该晶体的密度为
+1=5,则该合金中Ca和Cu的原子个数比为1:5;1mol晶体的质量为40+64×5=360g,1mol晶体含有NA个晶胞,因此该晶体的密度为![]() ,故答案为:1:5;
,故答案为:1:5;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列配合物的配位数不是6的是( )
A.Na3[AlF6]
B.Na2[SiF6]
C.[Cu(NH3)4](OH)2
D.[Pt(NH3)2Cl4]Cl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
B.若A为铁,则足量A与X在室温下即可完全反应
C .X使蔗糖变黑的现象主要体现了X的脱水性
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。
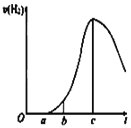
(1)关于图像的描述不正确的是______
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式___________________________
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_______
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3;
其中,你认为不合理的方案有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子。请根据以上信息,回答下列问题(用所对应的元素符号表示):
(1)A、B、E的第一电离能由小到大的顺序为 。
(2)氢化物A2H4分子中A原子采取 杂化。
(3)按原子的外围电子排布分区,元素F在 区,基态F原子的电子排布式为 。
(4)元素A和C可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为 。
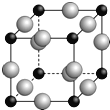
(5)A、F形成某种化合物的晶胞结构如下图所示(其中A显﹣3价,每个球均表示1个原子),则其化学式为 。设阿伏加德罗常数为NA,距离最近的两个F原子的核间距为a cm,则该晶胞的密度为(用含a和NA的代数式表示) g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com