
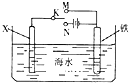
| A. | 若X为碳棒,开关K置于N处,可以加快铁的腐蚀 | |
| B. | 若X为碳棒,开关K置于N处,则X极附近溶液变黄色 | |
| C. | 若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH- |
分析 A.若X为碳棒,开关K置于N处,此时构成的是电解池;
B.若X为碳棒,开关K置于N处,此时构成的是电解池,阳极上氯离子失电子;
C.若X为锌,开关K置于M处,此时构成的是原电池,X为负极,Y为正极;
D.若X为锌,开关K置于M处,为锌的吸氧腐蚀.
解答 解:A.若X为碳棒,开关K置于N处,此时构成的是电解池,铁棒做阴极,阴极上阳离子发生还原反应,Fe不反应,故可以减缓铁的腐蚀,故A错误;
B.若X为碳,开关K置于N处,此时构成的是电解池,X为阳极,阳极上阴离子失电子生成氯气,因此X极上会有黄绿色气体生成,溶液不能变黄色,故B错误;
C.若X为锌,开关K置于M处,此时构成的是原电池,X为负极,Y为正极,Fe作正极被保护,即保护铁电极则为牺牲阳极的阴极保护法,故C正确;
D.若X为锌,开关K置于M处,为锌的吸氧腐蚀,X上Zn失电子生成锌离子,则X电极的反应式为:Zn-2e=Zn2+,故D错误.
故选C.
点评 本题综合考查了电解池、原电池的内容,属于中等难度题型,解题时,应首先判断所给的装置是原电池还是电解池,其次再根据确定的装置类型进行解答.


科目:高中化学 来源: 题型:解答题
 (1)实验室用NaNO3固体配制500mL 0.40mol/L NaNO3溶液.
(1)实验室用NaNO3固体配制500mL 0.40mol/L NaNO3溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kw>1×10-14 | B. | 水电离的c(H+)>1×10-13 mol/L | ||
| C. | pH>13 | D. | c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 任何物质所含的分子数均为NA | |
| B. | 14 g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | HA与BOH的电离常数相等 | ||
| C. | 混合溶液中,c(H+)=$\sqrt{{K}_{W}}$mol/L | D. | 混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与碳酸氢钠溶液混合:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O | |
| B. | 向FeBr2溶液中通入等量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl- | |
| C. | 将Al投入NaOH的重水溶液:2Al+2OH-+2D2O→2AlO2-+3D2↑ | |
| D. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
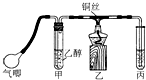 利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).
利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 | |
| B. | 除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 | |
| C. | 加热NaOH和少量溴乙烷的混合液后滴加硝酸银,可生成浅黄色沉淀 | |
| D. | 制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯,振荡混合均匀后,保持55℃水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
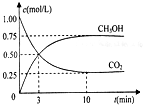 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com