
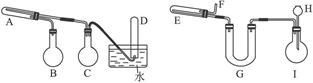
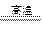 3Fe+4H2O
3Fe+4H2O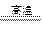 Fe3O4+4H2
Fe3O4+4H2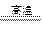 3Fe+4H2O
3Fe+4H2O

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:实验题
 N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4和NO2的混合气体达到平衡时c(NO2)="0.0300" mol·L-1。
N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4和NO2的混合气体达到平衡时c(NO2)="0.0300" mol·L-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
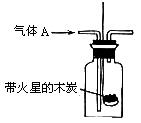

| 编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
| a | 在烧瓶中加热适量浓HNO3 | 充满红棕色气体,木条不复燃,火星熄灭 | NO2不支持燃烧 |
| b | 加热AgNO3固体 | 充满红棕色气体,木条复燃 | NO2支持燃烧 |
| c | 加热Cu(NO3)2固体 | 充满红棕色气体,木条复燃 | NO2支持燃烧 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在硫酸铜晶体结晶水含量的 测定实验中,加热后的硫酸铜应在空气中冷却后 测定实验中,加热后的硫酸铜应在空气中冷却后 再称量 再称量 |
| B.在中和热的测定实验中,应用稀的强酸和强碱作为反应物进行实验 |
| C.在Fe(OH)3胶体的电泳实验中,靠近阴极附近的液体的颜色会加深 |
| D.在硫酸铜晶体结晶水含量的测定实验中,加热不够充分将会使实验结果偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com