
【题目】下列说法正确的是()
A.红外光谱只能检测化学键,不能检测官能团
B.核磁共振氢谱显示二甲苯只有两组吸收峰且面积比为3:2
C.煤是由苯和甲苯等有机物和无机物组成的混合物
D.石油中溶有![]() 的烷烃
的烷烃
【答案】D
【解析】
A.红外光谱可以用来检测物质具有的化学键及官能团;
B.甲苯存在三种同分异构体,邻间对位的二甲苯;
C.煤是由有机物和少量无机物组成的复杂的混合物;
D.石油是由各种烷烃、环烷烃、芳香烃等组成的混合物,汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在![]() 范围内,据此解题。
范围内,据此解题。
![]() 红外光谱可以检测有机物具有的化学键和官能团,故A错误;
红外光谱可以检测有机物具有的化学键和官能团,故A错误;
B.二甲苯存在三种同分异构体,邻间对位的二甲苯,其中对二甲苯只有两组吸收峰且面积比为3:2,邻二甲苯存在三组峰,间二甲苯四组峰,故B错误;
C.煤是由有机物和少量无机物组成的复杂的混合物,主要含有C元素,苯和甲苯等有机物是煤干馏的产物,故C错误;
D.石油是由各种烷烃、环烷烃、芳香烃等组成的混合物,石油中溶有![]() 的烷烃,故D正确;
的烷烃,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】(1)配平以下方程式
K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
以上反应中失电子的物质是_________,还原产物是______,每生成lmol这种还原产物,将有_________mol电子发生转移.氧化剂与还原剂的物质的量之比为_________.
(2)人体内的铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以补铁时,应补充含Fe2+的亚铁盐。服用维生素C可使食物中的Fe3+转化成Fe2+,利于人体对铁的吸收。
Ⅰ人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+![]() Fe3+。在过程A中,Fe2+作__________剂,过程B中,Fe3+作____________剂。
Fe3+。在过程A中,Fe2+作__________剂,过程B中,Fe3+作____________剂。
Ⅱ“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作_______剂,具有_____________性。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则冋时会生成水的质量为____g.
(4)除去Na2CO3粉末中混入的NaHCO3杂质用______方法,化学方程式为_______.
(5)向FeBr2溶液中通入足量Cl2(己知氧化性Cl2>Br2>Fe3+)化学方程式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列两个热化学方程式,回答下列问题:
2H2(g)+O2(g)![]() 2H2O(1) ΔH=571.6 kJ · mol1
2H2O(1) ΔH=571.6 kJ · mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
(1)H2的燃烧热为_______,C3H8的燃烧热为_______。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为__________molL-1。若从中取出50 mL,其物质的量浓度为__________ molL-1。若将这50 mL溶液用水稀释到100 mL,所得溶液中![]() 的物质的量浓度为__________ molL-1,
的物质的量浓度为__________ molL-1,![]() 的物质的量浓度为__________ molL-1。
的物质的量浓度为__________ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银白色固体A:①放在空气中可氧化生成白色固体B;②将A点燃,火焰呈黄色,生成淡黄色固体C;③A、B、C均可与无色液体D反应,生成碱性物质E,其中A跟D反应时还可以生成可燃性气体F,C跟D反应则生成另一种气体G;④F和G混合后遇火可剧烈反应而发生爆炸,并生成D。据此判断:
(1)A______,B______,C______,D________,E____,F_______,G_______。(填化学式)
(2)写出有关反应的化学方程式:
①___________________________________________。
②__________________________________________。
③__________________________________________。
④__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究Cu和H2O2的反应。
(猜想预测)
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
(实验探究)
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10 小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________。
(继续探究)
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2+ + 4NH3 [ Cu(NH3)4] 2+ ,[ Cu(NH3)4] 2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
装置 | 序号 | 试剂a | 现象 |
| ⅱ | 20 mL 30% H2O与4 mL 5 mol/L H2SO4 混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是________(用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
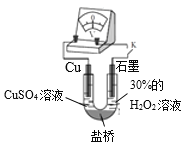
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁“发蓝”是指在钢铁的表面形成一层四氧化三铁的技术过程。其中第一步反应为:3Fe+ NaNO2+ 5 NaOH= 3Na2FeO2+ H2O+ NH3↑。关于该反应说法正确的是![]()
A.反应中N元素被氧化
B.NaFeO2既是氧化产物也是还原产物
C.整个反应过程中每有![]() 参加反应就转移
参加反应就转移![]() 电子
电子
D.氧化剂与还原剂的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
(1)产生的氢气在标准状况下的体积是__________;
(2)忽略溶液体积变化体积,反应后溶液中氢离子浓度是__________;
(3)要配制500mL 2mol/L的硫酸溶液,需用质量百分数为98%,密度为1.84g/cm3浓硫酸_______![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上60%的镁来自海水,从海水中提取镁工艺流程如图所示,下列说法正确的是( )
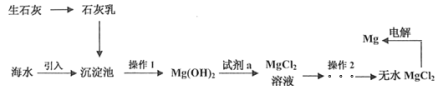
A.该工艺流程涉及的反应有分解反应、化合反应和置换反应
B.操作1为过滤,实验室里为加快过滤速度应用玻璃棒搅拌液体
C.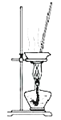 操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
D.该工艺的优点是原料来源广泛,同时获得重要的化工原料氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com