
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�顣
��.(1)���ơ��ء�þ������1 mol�ֱ�Ͷ�뵽������0.1 mol��L��1�������У���Ԥ��ʵ������________________�����ᷴӦ����ң�
(2)��NaOH��Һ��NH4Cl��Һ�������NH3��H2O���Ӷ���֤NaOH�ļ��Դ���NH3��H2O���̶�������֤Na�Ľ����Դ���N������Ϊ������Ƿ����______________����˵�����ɣ�_____________________��
��.������ͼװ�ÿ�����֤�ǽ����Եı仯���ɡ�
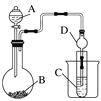
(3)����A������Ϊ____________�������D��������______________��
(4)ʵ����������ҩƷNa2S��KMnO4��Ũ���ᡢMnO2����ѡ�����ҩƷ���ʵ����֤�ȵķǽ����Դ�����װ��B��C����װҩƷ�ֱ�Ϊ____________��________��װ��C�е�ʵ������Ϊ�е���ɫ�������ɣ����ӷ���ʽΪ________________��
(5)��Ҫ֤���ǽ����ԣ�C>Si����A�м�________��B�м�Na2CO3��C�м�________���۲쵽C����Һ������Ϊ_________________________________��
���𰸡�I����1��K��Al��
��2�����������ü���ǿ���ȽϽ�����ǿ��ʱ��һ��Ҫ��Ԫ�ص�����������ˮ����ļ���ǿ���Ƚϣ���NH3H2O���ǵ�Ԫ�ص�����������ˮ���
II����3����Һ©������ֹ������
��4��Ũ���ᡢKMnO4��Na2S��S2��+Cl2�TS��+2Cl����
��5�����Na2SiO3���а�ɫ��״����������
�����������������I����1��Ԫ�صĽ�����Խǿ���䵥�������ˮ��ӦԽ���ң�
��2��Ԫ�ص�����������ˮ����ļ���Խǿ��Ԫ�صĽ�����Խǿ��
II����3�����������Ĺ���д������A�����ƣ����θ���ܾ��з�ֹ���������ã�
��4�����ʵ����֤�ǽ����ԣ�Cl��S������������Na2S��������ԭ��Ӧ����֤��
��5��Ҫ֤���ǽ����ԣ�C��Si������ͨ��������̼�����Ʒ�Ӧ���������ԵĹ�����֤����
�⣺I����1��ͬһ����Ԫ�أ�����������ԭ�����������������Ԫ�صĽ�����Խǿ��ͬһ���壬ԭ������Խ������Խǿ���䵥�������ˮ��ӦԽ���ң����Խ�����K��Na��Mg��Al����K�����ᷴӦ����ҡ�Al�����ᷴӦ�����������ʴ�Ϊ��K��Al��
��2����NaOH��Һ��NH4Cl��Һ�������NH3H2O������˵��NaOH�ļ��Դ���NH3H2O��������˵��Na�Ľ����Դ���N����ΪҪ��֤�����Ե�ǿ��������ͨ���Ƚ��������������Ӧ��ˮ����ļ��������бȽϣ���NH3H2O���ǵ�Ԫ�ص�����������ˮ����ʴ�Ϊ�����������ü���ǿ���ȽϽ�����ǿ��ʱ��һ��Ҫ��Ԫ�ص�����������ˮ����ļ���ǿ���Ƚϣ���NH3H2O���ǵ�Ԫ�ص�����������ˮ���
II����3������AΪ��Һ©�������θ����D�ܹ���ֹ���������Ա���C��Һ�������ƿ�У��ʴ�Ϊ����Һ©������ֹ������
��4�����ʵ����֤�ǽ����ԣ�Cl��S������������Na2S��������ԭ��Ӧ����֤����װ��A��B��C����װҩƷӦ�ֱ�ΪŨ���ᡢKMnO4��Na2S��Һ��װ��C�е�ʵ������Ϊ�е���ɫ�������ɣ�װ��C�з�����Ӧ�����ӷ���ʽΪS2��+Cl2�TS��+2Cl����
�ʴ�Ϊ��Ũ���ᡢKMnO4��Na2S��S2��+Cl2�TS��+2Cl����
��5����Ҫ֤���ǽ����ԣ�C��Si������ͨ��������̼�����Ʒ�Ӧ���������ԵĹ�����֤��������B�м�Na2CO3����A�п��Լ����ᣬͨ�������̼���Ƶķ�Ӧ����ȡCO2��Ȼ���CO2ͨ��C�е�Na2SiO3�У����Է�����Ӧ��Na2SiO3+CO2+H2O=H2SiO3��+Na2CO3��������ɫ��״�������Ӷ�����֤�����ԣ�H2CO3��H2SiO3���ʷǽ����ԣ�C��Si��
�ʴ�Ϊ�����Na2SiO3���а�ɫ��״����������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У����ܹ۲쵽���Ա仯����( )
A����һ���ĥ����þ������������ˮ��
B��������ͨ��FeCl2����Һ��
C�����̶���ļ�Ͷ��ˮ��
D������ˮ�μӵ�KI������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���һ��ȼ�ϵ�أ�����ͼ��ʾ����Ŀ����̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��
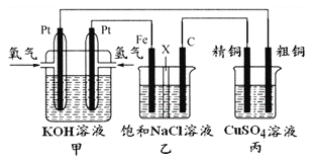
����Ҫ��ش�������⣺
��1��ͨ�������ĵ缫Ϊ ������������������������ĵ缫��ӦʽΪ ��
��2��ʯī�缫Ϊ �����������������������Ӧһ��ʱ�������װ���е����̪��Һ �������������ʯī����������Һ�ȱ�졣
��3�������ͭ�к���п���������ʣ���װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ� ��������� С�����䡱������ͭ�缫�ϵĵ缫��ӦʽΪ ��
��4��������װ�����Ȼ�����Һ�㹻�࣬���ڱ�״���£���224mL�����μӷ�Ӧ������װ���������ӽ���Ĥ�����Һ������ ����������� С�����䡱�����ұ仯�� �ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
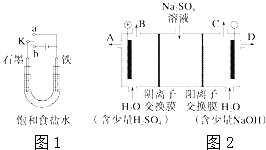
����Ŀ����1��ij����С��ͬѧ��ͼ1װ�ý���ʵ�飬�Իش��������⣺
������ʼʱ����K��a���ӣ����������绯ѧ��ʴ�е� ��ʴ��
������ʼʱ����K��b���ӣ����ܷ�Ӧ�����ӷ���ʽΪ ��
��2��â����ѧʽΪNa2SO410H2O����ɫ���壬������ˮ����һ�ֲַ��ܹ㷺�������ο����С��ͬѧ���룬���ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������ͼ2��ʾװ�õ����������Һ����ȡ������������������������ƣ����۴ӽ�ʡ��Դ���Ǵ����ԭ�ϵ������ʶ��Զ����ӷ�����ɫ��ѧ���
�ٸõ��۵�������ӦʽΪ ����ʱͨ�������ӽ���Ĥ�������� ������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
���Ƶõ�����������Һ�ӳ��ڣ��A������B������C����D���� ������
��ͨ�翪ʼ������������ҺpH�����������ԭ��
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ ����֪H2��ȼ����Ϊ285.8kJmol��1�����ȼ�ϵ�ع�������36g H2Oʱ���������� kJ������ת��Ϊ���ܣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���3.0molM��2.5molN�����2.0L���ܱ������У�������Ӧ�Ļ�ѧ����ʽΪ��3M(g)+N(g)![]() xP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.10 molL��1min��1������˵��������ǣ� ��
xP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.10 molL��1min��1������˵��������ǣ� ��
A��x��ֵΪ1 B��M��ƽ����Ӧ����Ϊ0.15 molL��1min��1
C��M��ת����Ϊ60% D��ƽ��ʱp��Ũ��Ϊ0.25 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��Na2CO3���Ʋ���
��SiO2��̫���ܵ��
���ɱ����˹�����
��NaCl���ƴ���
��Al2O3�����Ӹֹ�
��NaClO��������
��Fe2O3����ɫ�����Ϳ��
��MgO���ͻ����
A. 4 B. 5 C. 6 D. 7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ�䣬���ʵ�����Σ����������ȫ�����Ŀ���佹��������dz��ʺ˵�վ������ˮ�ѻ�����ˮ�ѣ���ˮ�Ѻ˵�վ�ڷ����ͬʱ�������������ɹ����ƺ��������У�![]() Pu���������й�
Pu���������й�![]() PuPu��˵������ȷ���ǣ� ��
PuPu��˵������ȷ���ǣ� ��
A. ![]() Pu��94������
Pu��94������
B. ![]() Pu�е���������������֮��Ϊ51
Pu�е���������������֮��Ϊ51
C. ![]() Pu���94������
Pu���94������
D. ![]() Pu�������
Pu�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɱ���ܱ������У�����һ������X��Y��������Ӧ��mX(g)![]() nY(g)
nY(g)
��H=QkJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ
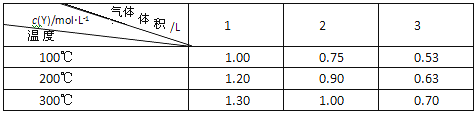
����˵����ȷ������ ��
A��m��n
B���¶Ȳ��䣬ѹǿ����Y��������������
C��Q��0
D��������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������һ��Ũ�ȵ����ᷴӦ������ֻ���ɵ�һ��ԭ������μӷ�Ӧ�ĵ����뱻
��ԭ��������ʵ���֮��Ϊ2��1ʱ����ԭ������
A��NO2 B��NO C��N2O D��N2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com