
【题目】碘和铁均是人体必需的微量元素。
(1)海带中含有丰富的以碘离子形式存在的碘元素。在实验室中,从海藻中提取碘的流程如下:

①上述流程中涉及下列操作,其中错误的是________________(填标号)。
A.将海藻灼烧成灰
B.过滤含I-溶液
C.下口放出含碘的苯溶液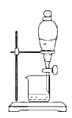
D.分离碘并回收苯
②写出步骤④发生反应的离子方程式:_______________________________________
③要证明步骤④所得溶液中含有碘单质,可加入___________________(填试剂名称),观察到________________________(填现象)说明溶液中存在碘。
(2)探究铁与稀硝酸的反应。用5.6gFe粉和含有0.3 mol HNO3的稀硝酸进行实验,若两种物质恰好完全反应,且HNO3只被还原成NO。回答下列问题:
①Fe粉与稀硝酸反应生成硝酸铁的化学方程式为___________________________________
②反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)=_________________。
③标准状况下,生成NO气体的体积为_________________L(保留两位小数)。
【答案】AC H2O2+2I-+2H+=I2+2H2O 淀粉溶液 溶液变蓝 Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O 1:3 1.68
【解析】
(1)①A. 固体的灼烧应在坩埚中进行,因此将海藻灼烧成灰,应在坩埚中进行,A错误;
B. 过滤时,应用玻璃棒引流,B正确;
C. 含碘的苯溶液的密度比水小,在上层,分液时,上层液体从分液漏斗的上口到出,C错误;
D. 分离回收苯时,应采用蒸馏装置,D正确;
故选AC;
②步骤④中的过氧化氢将I-氧化成I2,结合得失电子守恒、电荷守恒和原子守恒,可得方程式H2O2+2I-+2H+=I2+2H2O;
③根据淀粉遇碘变蓝的性质,证明步骤④所得溶液中含有碘单质,应加入淀粉溶液,若能观察到溶液变蓝色,则证明溶液中含有碘单质。
(2)①铁与硝酸反应生成硝酸铁、一氧化氮和水,反应过程中,Fe由0价变为+3价,N由+5变为+2,因此Fe和NO的系数都为1,再根据原子守恒进行配平,配平后的化学反应方程式为Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;
②5.6g铁的物质的量![]() ,0.1molFe与0.3mol硝酸反应,硝酸完全反应,结合方程式Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O可知,消耗掉的Fe的物质的量
,0.1molFe与0.3mol硝酸反应,硝酸完全反应,结合方程式Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O可知,消耗掉的Fe的物质的量![]() ,反应生成的硝酸铁的物质的量为0.075mol,则还剩余0.025mol的Fe与三价铁离子发生反应Fe+2Fe(NO3)3=3Fe(NO3)2,则参与反应的硝酸铁的物质的量为0.05mol,生成硝酸亚铁的物质的量为0.075mol,反应后溶液中剩余的硝酸铁为0.025mol,因此反应后所得溶液中
,反应生成的硝酸铁的物质的量为0.075mol,则还剩余0.025mol的Fe与三价铁离子发生反应Fe+2Fe(NO3)3=3Fe(NO3)2,则参与反应的硝酸铁的物质的量为0.05mol,生成硝酸亚铁的物质的量为0.075mol,反应后溶液中剩余的硝酸铁为0.025mol,因此反应后所得溶液中![]() ;
;
③0.3mol硝酸完全反应后生成NO的物质的量为0.075mol,该气体在标况下的体积![]() 。
。


科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯(难溶于水,密度比水大的油状液体)的反应原理,下列关于硝基苯的制备和纯化的装置不正确的是
![]()
A. 浓硫酸与浓硝酸混合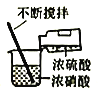
B. 制备硝基苯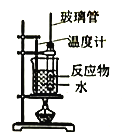
C. 用氢氧化钠溶液分离硝基苯中混有的酸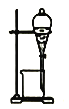
D. 分离硝基苯中混有的苯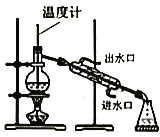
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-),温度为T℃时,向20.00mL 0.01mol·L-1氨水中滴入0.10mol·L-1的盐酸(不考虑溶质挥发),溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
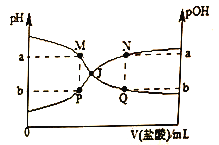
A. 曲线PJN表示溶液中pH的变化
B. 若M点水的电离程度与Q点相等,则Q点一定符合c(Cl-)>c(NH4+)+c(NH3·H2O)
C. M、P两点的数值之和a+b=14
D. pH与pOH交叉点J对应的V(盐酸)=20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
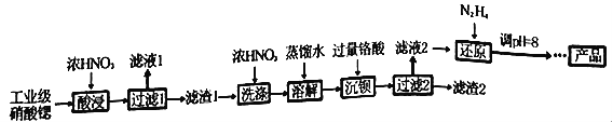
已知:①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为 BaCrO4(杂质不与硝酸反应)。②铬酸(H2CrO4)为弱酸。
(1)“酸浸”不能采用高温的原因是_________________________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_________________________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式_______________________________________________________。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是:___________。(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中 BaCrO4的含量,进行以下实验:
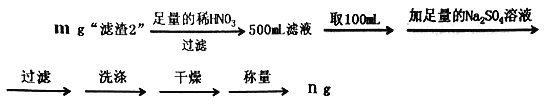
①判断Ba2+完全沉淀的方法:____________________________________________。
②“滤渣2”中BaCO4的质量分数为______________________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,可用于水果催熟。A可发生如图所示的一系列 化学反应。

回答下列问题:
(1)C的结构简式为_______________
(2)写出反应③的化学方程式:___________________,该反应是_____________(填反应类型)。
(3)E的相对分子质量是A的两倍,则与A互为同系物的E有________种,写出其中一种的结构简式:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+ 5/2O2(g) ![]() 2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1的说法中,正确的是 …( )
2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1的说法中,正确的是 …( )
A. 当10NA个电子转移时,该反应放出2600 kJ的能量
B. 当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C. 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则说明含水
②除 去乙醇中微量的水可加入金属钠,使其完全反应
③加热蒸馏含水的乙醇可获得无水乙醇
④在含 少量水的乙醇中加入石灰,然后再加热蒸馏可以获得无水乙醇
A.①③B.②④C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化,通常主要表现为热量的变化——吸热或者放热。下列有关说法不正确的是
A. 氢气在氧气中燃烧和在空气中燃烧都是放热反应
B. 煤的燃烧需要加热点燃,故是吸热反应
C. 放热反应的反应物的总能量高于生成物的总能量
D. 煅烧石灰石制生石灰是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com