
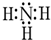 ,分子间存在氢键.
,分子间存在氢键.分析 短周期中的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,则Z处于第一周期,X、Y处于第二周期,可推知Z为H元素;Y元素原子的最外层电子数是它的电子层数的2倍,则其最外层电子数为4,则Y为C元素,其最高正价等于最低负价;X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和,X最外层电子数为4+1=5,则X为氮元素,能与H元素形成NH3,据此答题;
解答 解:短周期中的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,则Z处于第一周期,X、Y处于第二周期,可推知Z为H元素;Y元素原子的最外层电子数是它的电子层数的2倍,则其最外层电子数为4,则Y为C元素,其最高正价等于最低负价;X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和,X最外层电子数为4+1=5,则X为氮元素,能与H元素形成NH3,
(1)由上述分析可知,X、Y、Z三种元素的元素名称分别为:氮、碳、氢,
故答案为:氮;碳;氢;
(2)XZ3的化学式为NH3,NH3的电子式是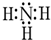 ,NH3分子之间存在氢键,
,NH3分子之间存在氢键,
故答案为:NH3;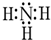 ;氢;
;氢;
(3)X最高价氧化物对应水化物的浓溶液为浓硝酸,与红热的碳单质反应的化学方程式为4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,
故答案为:4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O.
点评 本题考查结构性质与位置关系,推断元素是解题的关键,注意根据最外层电子数之和确定Z是推断的突破口,难度不大.


科目:高中化学 来源: 题型:选择题
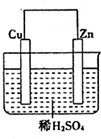 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | |||||||||||||||||
| f | h | i | |||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | k | ||||||||||||||
| l | |||||||||||||||||
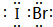 ,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
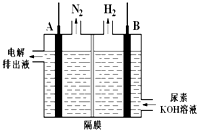
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时,温度计的水银球必须插入液面下 | |
| B. | 用浓氨水洗涤做过银镜反应的试管 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加直至沉淀刚好溶解为止 | |
| D. | 蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com