
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数小于0.1NA
B.22.4L(标准状况)氩气含有的分子数为0.5NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W 是中学化学中常见的四种不同粒子,其中X、W 为分子,Y、Z为离子它们之间存在如下所示的转化关系:
X+Y→Z+W Z+H+ →X Y+H+ →W
(1)如果X、Y、Z、W 均是10电子的粒子,请写出:
X的电子式:____________; W 的电子式:_________________。
(2)如果X和Z均是18电子的粒子,Y 和 W 均是10电子的粒子,请写出:
①X与Y(足量)在溶液中反应的离子方程式:______________________。
②根据上述离子方程式,可判断Z与 Y 结合质子(H+ )的能力大小是 ________ >_____ 。(用化学式或离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】春节期间要注意饮食健康。
(1)平时要多喝水。水在人体中有重要的生理功能。下列物质在人体中可以水解的是___ (填字母)
a.葡萄糖 b.氨基酸 c.油脂
(2)合理选择饮食。鸡鸭鱼肉是常见食材,它们富含的营养物质是油脂和___;富含淀粉的面点老少皆宜,淀粉的化学式是______;蔬菜和水果富含维生素C,组成维生素C的元素是___(填写元素符号)。
(3)橙汁是家宴的常用饮品。某品牌橙汁中含有白砂糖、精制盐、柠檬黄和苯甲酸钠,这几种物质中属于着色剂的是__。
(4)饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式_________。
(5)最好使用加碘食盐.是因为碘是人体内合成____激素的主要原料,缺碘会引起疾病。加碘食盐加入的是碘酸钾,其化学式为_____,其中碘元素的化合价为____;在食物中_____等海产品中含碘较多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,且A、B、C含有相同元素甲,可以发生如下转化关系(水参与的反应,水未标出)。
![]()
(1)若A、B、C的焰色反应呈黄色,C为淡黄色固体,则X是__________。
(2)若A、B、C的焰色反应呈黄色,X是CO2,写出B→C反应的方程式_________。
(3)若B是FeCl3,则X一定是_________,写出B→C反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
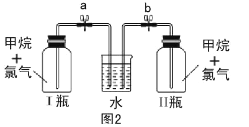
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:
甲:方案探究甲烷与氧化剂反应(如图1所示);
乙:方案探究甲烷与氯气反应的条件(如图2所示)。
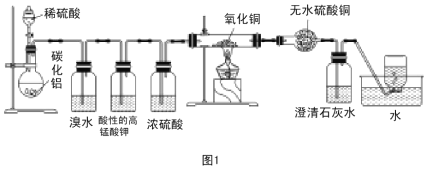
甲方案实验现象:溴水不褪色,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为__________。
(2)实验甲中浓硫酸的作用是 ______,集气瓶中收集到的气体 ____(填“能”或“不能”)直接排入空气中。
(3)下列对甲方案实验中的有关现象与结论的叙述都正确的是________(填标号)。
A.酸性高锰酸钾溶液不褪色,结论是通常条件下甲烷不能与强氧化剂反应
B.硬质玻璃管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应
C.硬质玻璃管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(4)写出甲方案实验中硬质玻璃管里可能发生反应的化学方程式:___(假设消耗甲烷与氧化铜的物质的量之比为2:7)
(5)—段时间后,观察到图2装置中出现的实验现象是 ________;然后打开弹簧夹a、b,现察到的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧生成,下列说法不正确的是![]()
A.![]() 和
和![]() 的相互转化是物理变化
的相互转化是物理变化
B.![]() 和
和![]() 互为同素异形
互为同素异形
C.等物质的量的![]() 和
和![]() 含有的质子数不相同
含有的质子数不相同
D.在相同的温度与压强下,等体积的![]() 和
和![]() 含有相同的分子数
含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO![]() 、CO
、CO![]() 、NH
、NH![]() 、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时观察到红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体:向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时观察到红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体:向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.CO![]() 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
B.Cl-一定存在,且c(Cl-)=0.4mol/L
C.SO![]() 、NH
、NH![]() 一定存在,CO32-可能存在
一定存在,CO32-可能存在
D.原溶液中至少存在上述离子中的4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似。写出在水中联氨第一步电离反应的方程式_______________。氯化镁溶液在某条件下可生Mg(OH)Cl沉淀,请写出相关离子方程式_________
(2)实验室可通过向盛装有碱石灰的锥形瓶中滴加浓氨水来制取氨气,请利用相关化学反应原理来解释______________________________
(3)室温下向10mL0.1 mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示

则HA为_______电解质(填“强”或“弱”),a点所示溶液c(Na)_____c(A)(填“>”、“<”或“”=),a、b两点所示溶液中水的电离程度a_______b(填“>”、“<”或“"=)。
(4)25℃时0.05mol/L的醋酸溶液,pH=______ 该溶液中水电离出的c(H+)=____(已知室温下醋酸电离平衡常数为2.0×10-5)
(5)常温下,0.01mol/L的HCN溶液加水稀释1000倍的过程中,下列选项增大的是_____
A.![]() B.Kac(HCN) C.
B.Kac(HCN) C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表所示:

请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是_____(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com