
 ⑤O2与O3
⑤O2与O3 二者结构为正四面体,结构相同,分子式相同,属于同种物质;
二者结构为正四面体,结构相同,分子式相同,属于同种物质;| 11.2L |
| 22.4L/mol |
| 10.8g |
| 18g/mol |
| 0.5mol |
| 0.1mol |
| 0.6mol×2 |
| 0.1mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
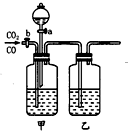 为将CO2和CO进行分离并得到干燥的CO2和CO,现设计一套装置(如图).
为将CO2和CO进行分离并得到干燥的CO2和CO,现设计一套装置(如图).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、起始时C的物质的量及C的转化率一定为3 mol和10% |
| B、Q1>Q2 |
| C、Q2一定小于Q1 |
| D、若乙容器是一个体积不变的绝热容器,则反应达平衡后,乙中的压强一定大于甲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com