
 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;分析 (1)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合;钡离子与硫酸根离子结合生成硫酸钡沉淀;
(2)应用硫酸与蒸馏水进行进行沉淀洗涤;具体方法是取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
(3)固体灼烧时温度较高,一般在坩埚中进行;固体受热不均时会飞溅;
(4)根据硫酸钡质量计算氯化钡质量,进而计算水的质量,根据二者质量之比确定x的值;
(5)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大.
解答 解:(1)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合,氯化钡的电子式为 ;钡离子与硫酸根离子结合生成硫酸钡沉淀,其反应的离子方程式为:SO42-+Ba2+=BaSO4↓;
;钡离子与硫酸根离子结合生成硫酸钡沉淀,其反应的离子方程式为:SO42-+Ba2+=BaSO4↓;
故答案为: ;SO42-+Ba2+=BaSO4↓;
;SO42-+Ba2+=BaSO4↓;
(2)应用硫酸与蒸馏水进行进行沉淀洗涤,具体方法是取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
故答案为:蒸馏水;取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
(3)固体灼烧时温度较高,一般在坩埚中进行,则灼烧沉淀的容器是坩埚;固体受热不均时会飞溅,所以要用玻璃棒搅拌固体,使其均匀受热;
故答案为:坩埚;使沉淀均匀受热,避免飞溅;
(4)沉淀1.165g为硫酸钡质量,其物质的量=$\frac{1.165g}{233g/mol}$=0.005mol,故氯化钡晶体中氯化钡的质量=0.005mol×208g/mol=1.04g,含有结晶水的质量=1.222g-1.04g=0.182g,则208:18x=1.04g:0.182g,解得x≈2,
故答案为:2;
(5)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大,故x的值偏高,故答案为:偏高.
点评 本题考查物质组成的测定,主要涉及电子式、离子方程式、基本实验操作、计算、误差分析等,题目难度中等,分子式的确定是难点,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:选择题
| A. | x=y=z | B. | x>y=z | C. | x<y=z | D. | x=y<z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
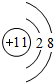 ,C的原子结构示意图是
,C的原子结构示意图是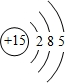 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中含δ键又含π键 | D. | 每生成1.8gH2O消耗2.24LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的溶液与pH=11的溶液混合后pH值不一定等于7 | |
| B. | 同浓度的Na2CO3溶液室温时的pH值必定大于60℃的pH值 | |
| C. | 同浓度的钾盐溶液,酸式盐的pH值必定小于对应正盐的pH值 | |
| D. | 因为碳酸的酸性比亚硫酸弱,所以室温下同浓度的碳酸钠溶液的pH值小于亚硫酸钠溶液pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com