
A.![]() (g)+
(g)+![]()
![]()
![]() (g)+98.3KJ
(g)+98.3KJ
B.2 ![]() (g)+
(g)+ ![]() (g)
(g) ![]() 2
2![]() (g)+196.6KJ
(g)+196.6KJ
C.![]() (g)+
(g)+![]()
![]() (g)
(g) ![]()
![]() (g)+98.3KJ
(g)+98.3KJ
D.2![]() (g)+
(g)+ ![]() (g)
(g) ![]() 2
2![]() (g)-196.6KJ
(g)-196.6KJ
科目:高中化学 来源: 题型:阅读理解
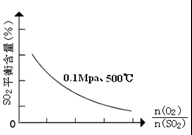 (1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:| 催化剂 |
| △ |
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
| n(O2) |
| n(SO2) |
| n(O2) |
| n(sO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:021
在一定条件下,当64 g SO2气体被氧气氧化生成SO3气体时,共放热98.3 KJ。据此,下列热化学方程式正确的是 ( )
A.![]() (g)+
(g)+![]()
![]()
![]() (g)+98.3KJ
(g)+98.3KJ
B.2 ![]() (g)+
(g)+ ![]() (g)
(g) ![]() 2
2![]() (g)+196.6KJ
(g)+196.6KJ
C.![]() (g)+
(g)+![]()
![]() (g)
(g) ![]()
![]() (g)+98.3KJ
(g)+98.3KJ
D.2![]() (g)+
(g)+ ![]() (g)
(g) ![]() 2
2![]() (g)-196.6KJ
(g)-196.6KJ
查看答案和解析>>
科目:高中化学 来源:山东省青州一中2012届高三化学一轮跟踪训练:第6章第1讲化学反应中的热效应(鲁科版) 题型:013
|
在一定条件下,当64 g SO2气体被氧化成SO3气体时,共放出热量98.3 kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是 | |
| [ ] | |
A. |
SO2(g)+ |
B. |
2SO2(g)+O2(g) |
C. |
SO2(g)+ |
D. |
2SO2(g)+O2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com