
| A. | 乙烯的结构简式:C2H4 | B. | F原子结构示意图: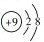 | ||
| C. | NH3的结构式: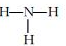 | D. | HCl的电子式: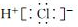 |
分析 A.乙烯的官能团为碳碳双键,结构简式中必须标出官能团;
B.氟原子核电荷数、核外电子数都是9, 为氟离子的电子式;
为氟离子的电子式;
C.氨气是氮原子和氢原子之间通过共价单键形成的三角锥形结构;
D.氢原子最外层1个电子,氯原子最外层7个电子,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物.
解答 解:A.乙烯分子含有官能团碳碳双键,乙烯的结构简式为CH2=CH2,故A错误;
B.氟原子核外电子数为9,氟原子正确的结构示意图为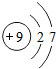 ,故B错误;
,故B错误;
C.氨气是氮原子和氢原子之间通过共价单键形成的三角锥形结构,结构式为: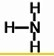 ,故C正确;
,故C正确;
D.HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为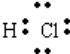 ,故D错误,故选C.
,故D错误,故选C.
点评 本题主要考查了电子式的书写、结构简式、结构式等,题目难度不大,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法.


科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO4 2-+S↓+H2O | |
| C. | 10 mL 0.1 mol/L FeI2溶液与标况下0.224L Cl2:Fe2++Cl2=2Cl-+2Fe3+ | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,任何电解质的稀溶液中,pC(H+)+pC(OH-)=14 | |
| B. | 0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大 | |
| C. | 0.01mol/L的BaCl2 溶液中,pC(Cl-)=2pC(Ba2+) | |
| D. | 用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H10和C6H6 | B. | C2H6和C2H4O2 | C. | C3H6和C3H8 | D. | C2H6和C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的速率主要①决定 | B. | HClI是该反应的催化剂 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,该反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.
A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该转化过程是物理变化 | |
| B. | 1molCO2原子晶体中含2molC-O键 | |
| C. | CO2原子晶体的熔点高于SiO2 | |
| D. | CO2的原子晶体和分子晶体互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
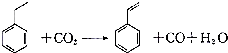
| A. | 分子中含有5个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
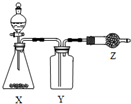 如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )| 选项 | X | Y | Z |
| A | 食盐、浓硫酸 | HCl | 碱石灰 |
| B | CaO、浓氨水 | NH3 | 无水CaCl2 |
| C | Cu、浓硝酸 | NO2 | 碱石灰 |
| D | 电石、食盐水 | C2H2 | 含溴水的棉花 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com