
【题目】在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
A. Fe3+ B. Cr3+ C. Zn2+ D. Mg2+
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下述实验不能达到预期实验目的是( )
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO4.5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1mol.L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3-+H2O![]() H2SO3+OH- ① HSO3-
H2SO3+OH- ① HSO3-![]() H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的
H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的
A. 加入少量金属 Na,平衡①左移,平衡②右移,溶液中 c(HSO3-)增大
B. 加入少量NaOH溶液,c(SO32-)/c(HSO3-)、c(OH-)/c(H+)的值均增大
C. 加入少量Na2SO3 固体,则 c(H+)+c(Na+)=c(HSO3-)+c(OH-)+1/2c(SO32-)
D. 加入氨水至中性,则 2c(Na+)=c(SO32-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠俗称“小苏打”,在生活、生产中用途广泛。
(1)泡沫灭火器中主要成分是NaHCO3溶液和Al2(SO4)3溶液,两者混合后发生双水解反应生成Al(OH)3和CO2进行灭火,写出该反应的化学方程式_________________________________________________。
(2)Na2O2和NaHCO3都属于钠的化合物,它具有很强的氧化性。少量Na2O2与FeCl2溶液能发生如下反应:____Na2O2+____FeCl2+____H2O→____Fe(OH)3![]() +____FeCl3+____NaCl,已知FeCl2前面系数为6,配平上述化学方程式______,并标出电子转移方向和数目______。该反应中被还原的元素是_________,氧化产物是_________。
+____FeCl3+____NaCl,已知FeCl2前面系数为6,配平上述化学方程式______,并标出电子转移方向和数目______。该反应中被还原的元素是_________,氧化产物是_________。
(3)向NaHCO3溶液中加入少许Ba(OH)2固体,忽略溶液体积变化,溶液中的c(CO32-)的变化是_____(选填“增大”、“减小”或“不变”)。
(4)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤 ②不通入氨,冷却、加食盐,过滤对两种方法的评价正确的是______(选填编号)。
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(5)已知HCO3-在水中既能水解也能电离。NaHCO3溶液呈碱性,溶液中c(H2CO3)___c(CO32-)(选填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是
A | B | C | D |
|
|
|
|
银器用除锈剂见新 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
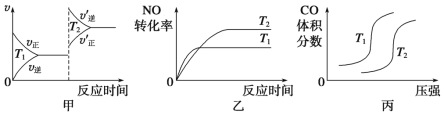
【题目】对汽车加装尾气净化装置,可使有毒气体(CO、NO等)相互反应转化为无毒气体。
(1)2CO(g)+2NO(g)===2CO2(g)+N2(g) ΔH<0,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。830℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。830℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为K=________________。
②乙容器中CO的平衡转化率为________。
比较甲、丙两容器中CO的平衡转化率:甲________丙(填“>”、“=”或“<”)。
③丙容器中,通过改变温度,使CO的平衡转化率降低,则温度________(填“升高”或“降低”)。
(3)以天然气为原料制备甲醇的方法有水煤气法和直接氧化法。涉及的反应有:
直接氧化法: 2CH4(g)+O2(g)=2CH3OH(g) ΔH1=-251kJ·mol-1
水煤气法: 2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH2=-70.8kJ·mol-1
CO(g) +2H2(g) =CH3OH(g) ΔH3
则ΔH3=__________kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间。以下叙述正确的是( )
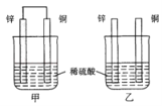
A. 两烧杯中铜片表面均有气泡产生
B. 甲烧杯中的电流与阳离子流向均为Zn→Cu
C. 两烧杯中溶液的pH均增大
D. 两烧杯在相同时间内转移电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
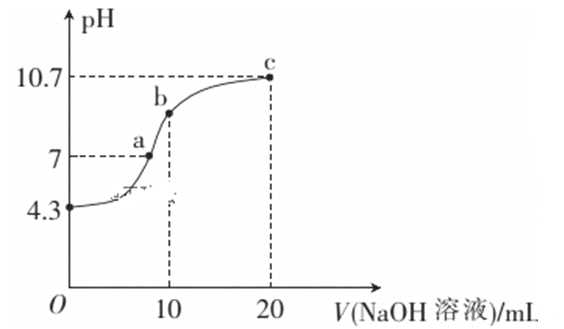
①写出H2N2O2在水溶液中的电离方程式:______________。
②c点溶液中个离子溶度由大到小的顺序_______________________________
③b点时溶液中c(H2N2O2)_____ c(N2O22-)(填“>”、“<”或“=”,下同)。
④a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组设计如下所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。
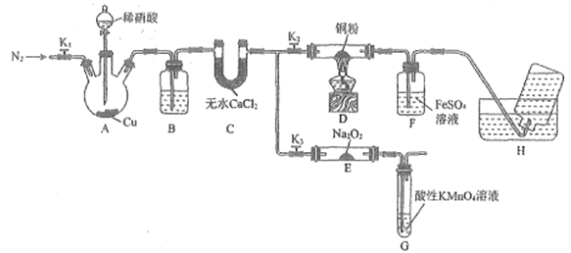
已知:①NO与Na2O2可发生反应2NO+Na2O2===2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为NO3-
③在溶液中存在平衡FeSO4+NO![]() Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是______________________。
(2)装置B中盛放的试剂为水,其作用是______________________。
(3)装置F中的实验现象为___________。装置H中收集的气体为___________(填化学式)。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是______________________。
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有___________(填化学式)。
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO2-可将MnO4-还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①滴定过程中发生反应的离子方程式为______________________。
②滴定过程中酸性KMnO4溶液的作用是___________。
③样品中NaNO2的质量分数为___________用含有a、b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com