
| A. | Fe3O4可以写成FeO•Fe2O3,Pb3O4也可以写成PbO•Pb2O3 | |
| B. | 不能用电解AlCl3溶液来制取金属铝,也不能用电解MgCl2溶液来制取金属镁 | |
| C. | Fe和S直接化合不能得到Fe2S3,Al和S直接化合也不能得到Al2S3 | |
| D. | FeS可以和稀硫酸反应制取硫化氢气体,CuS也可以和稀硫酸反应制取硫化氢气体 |
分析 A.Fe3O4中Fe元素化合价为+2价、+3价;Pb3O4中Pb元素化合价为+2价、+4价;
B.熔融状态下氯化铝不导电,如果电解氯化镁溶液时,阴极上氢离子放电而不是镁离子放电,所以得不到Mg;
C.S具有弱氧化性,能变价金属反应将金属氧化为较低价态;
D.CuS不溶于稀硫酸.
解答 解:A.Pb的化合价为+2价、+4价,不存在+3价,Pb3O4可表示为2PbO•PbO2,故A错误;
B.熔融状态下氯化铝不导电,应该电解熔融氧化铝冶炼铝;Mg是活泼金属,如果电解氯化镁溶液时,阴极上氢离子放电生成氢气,而不是镁离子放电,所以得不到Mg,应该采用电解熔融氯化镁方法冶炼Mg,故B正确;
C.S具有弱氧化性,能变价金属反应将金属氧化为较低价态,所以Fe和S加热生成FeS,Al元素只有一种正化合价,所以Al和S加热生成Al2S3,故C错误;
D.FeS和稀硫酸反应生成硫酸亚铁和硫化氢,但CuS不溶于稀硫酸,所以CuS不能和稀硫酸反应生成硫化氢,故D错误;
故选B.
点评 本题考查元素化合物知识,涉及金属冶炼、S的性质、硫化物的性质等知识点,明确规律中的反常现象是解本题关键,注意不能采用电解熔融氯化铝冶炼铝的原因,为易错点.


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题

| A. | 除⑤⑥外 | B. | 除④⑦⑧外 | C. | 除④⑤⑥⑧外 | D. | 全对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COOH溶液中:c(CH3COO-)<c(H+) | |
| B. | 0.1mol•L-1NH4Cl溶液中:c(NH+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 浓度均为0.1mol•L-1NH4Cl、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序:CH3COONH>NH4Cl>NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
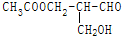 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在与Br2作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
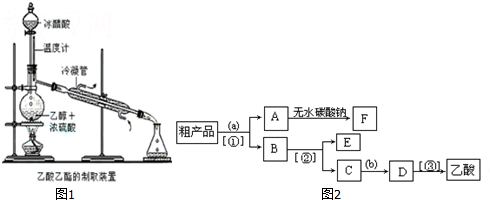
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只存在于乙酸分子中 | B. | 只存在于乙醇分子中 | ||
| C. | 只存在于乙醇、乙酸乙酯分子中 | D. | 只存在于乙酸、乙酸乙酯分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
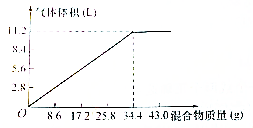 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4固定混合物共热,若加入混合物的质量和产生气体的体积(已换算成标准装)的关系如图所示(假定生成的NH3全部逸出).试计算:
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4固定混合物共热,若加入混合物的质量和产生气体的体积(已换算成标准装)的关系如图所示(假定生成的NH3全部逸出).试计算:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与水以任意比互溶 | B. | 无色、无味的液体 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能与金属钠发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com