
| A. | 日常生活中使用的硬币都是纯金、白银打造的 | |
| B. | 塑化剂对人体有害,不可用于食品添加剂 | |
| C. | SO2可用于漂白纸张,亦可漂白日常生活中食的馒头 | |
| D. | “药毒三分”其实是没有科学依据的,只要有效超剂里也无所谓 |
分析 A.依据硬币的成分解答;
B.塑化剂有毒,对人体有害;
C.二氧化硫有毒;
D.凡是药物都有一定的毒性和副作用,因此要根据病情需要,恰当选择药物并合理使用.
解答 解:A.我们日常生活中使用的硬币都是合金,如铜镍、铜锌等合金,不是使用纯金、纯银,故A错误;
B.塑化剂有毒,对人体有害,不能用于食品添加剂,故B正确;
C.二氧化硫有毒,不能用于食品漂白,故C错误;
D.凡是药物都有一定的毒性和副作用,因此要根据病情需要,恰当选择药物并合理使用,超剂量用药对人体有害,故D错误;
故选:B.
点评 本题考查了生活中常用的化学知识,熟悉乙醇、二氧化硫、塑化剂的性质及用途是解题关键,注意安全用药应根据病情需要,正确选择药物的品种、剂量和服用时间等,题目难度不大.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:推断题
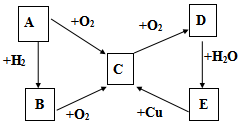 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
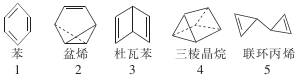 在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )| A. | 1~5对应的结构均能与氢气在一定条件下发生加成反应 | |
| B. | 1~5对应的结构中的一氯取代物只有1种的有3个 | |
| C. | 1~5对应的结构中所有原子均可能处于同一平面的有1个 | |
| D. | 1~5对应的结构中能使溴的四氯化碳溶液褪色的有4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H6和C5H8的烃 | B. | 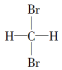 和 和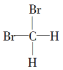 | ||
| C. | 符合CnH2n通式的烃 | D. | 分子式为C4H10和C20H42的烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;
某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液中通入足量的SO2气体后,所得溶液中2c(Ba2+)═c(Cl-) | |
| B. | 某溶液由水电离的c(H+)=1×10-amol/L,若a>7,则该溶液的pH一定为14-a | |
| C. | 物质的量浓度相等的H2S和NaHS混合溶液:c(Na+)═2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 常温下,若0.1mol/L NaHY溶液的pH=4,则该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H2Y)>c(Y2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液中:K+、Cu2+、SO42- | |
| B. | 饱和氯水中:Na+、SO42-、Br- | |
| C. | 1.0mol•L-1的KNO3溶液中:Fe2+、H+、Cl- | |
| D. | c(OH-)/c(H+)=1×1014溶液中:Ba2+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
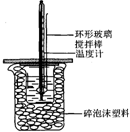 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
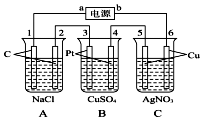 如图,通电5min后,电极5的质量增加2.16g,回答:
如图,通电5min后,电极5的质量增加2.16g,回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com