
| ||
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
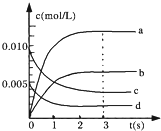 ( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的交化如下表:
( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的交化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
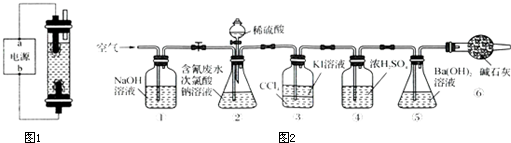

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
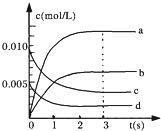
查看答案和解析>>
科目:高中化学 来源: 题型:
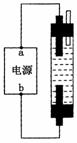 某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱
某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱
和NaCl溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力
的消毒液,设计了如右图的装置,则对电源电极名称和消毒液的主
要成分判断正确的是 ( )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com