
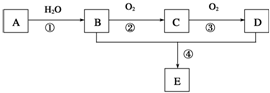
 已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| 浓H2SO4 |
| △ |
| 催化剂 |
| 浓H2SO4 |
| △ |


科目:高中化学 来源: 题型:
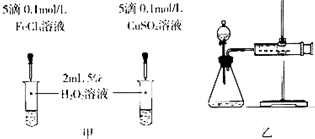
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有 气泡产生. |
查看答案和解析>>
科目:高中化学 来源: 题型:
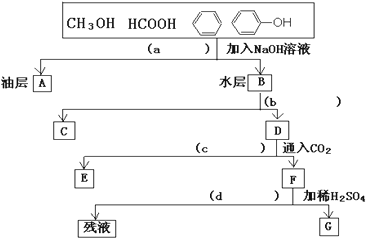
查看答案和解析>>
科目:高中化学 来源: 题型:
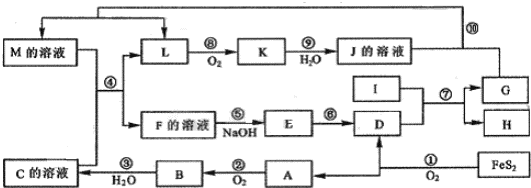
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2Y在电离时:H2Y+H2O?HY-+H3O+ |
| B、在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+) |
| C、在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
| D、HY-水解方程式为:HY-+H2O?Y2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙酸是生活中的一种常见有机物,它的分子结构模型如图所示.
乙酸是生活中的一种常见有机物,它的分子结构模型如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com