
【题目】C、N、O、Na、Al、Si、S、Cl是常见的八种元素
请回答下列问题:
(1)Si在元素周期表中的位置为__ ;CO2的电子式是_______。
(2)上述元素中原子半径最大的是(写元素符号)______;最高价氧化物对应的水化物酸性最强的是__________(写化学式)。
(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是__。
a.O2与H2S溶液反应,溶液变浑浊
b.O和S两元素的简单氢化物受热分解,前者的分解温度高
c.在氧化还原反应中,1molO2比1molS得电子多
(4)金刚石具有优良的耐磨,耐腐蚀性,应用广泛。一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为_____,除去粗产品中少里钠的试剂为_______。
(5)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图l),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。0~t1时,原电池的负极是Al片,此时,正极的电极反应式是_______,溶液中的H+向__极移动。t1时,原电池中电子流动方向发生改变,其原因是:___________。

【答案】 第三周期第ⅥA族 ![]() Na HClO4 a b 过滤 水(或乙醇) 2H++NO3-+e-=NO2↑+H2O 正 Al在浓HNO3中发生钝化,氧化膜阻止了Al的进一步反应
Na HClO4 a b 过滤 水(或乙醇) 2H++NO3-+e-=NO2↑+H2O 正 Al在浓HNO3中发生钝化,氧化膜阻止了Al的进一步反应
【解析】(1)Si的原子序数是14,在元素周期表中的位置为第三周期第ⅥA族;CO2是共价化合物,电子式是![]() 。(2)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,上述元素中原子半径最大的是Na;最高价氧化物对应的水化物酸性最强的是HClO4。(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是__。
。(2)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,上述元素中原子半径最大的是Na;最高价氧化物对应的水化物酸性最强的是HClO4。(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是__。
a.O2与H2S溶液反应,溶液变浑浊,说明氧气能把硫置换出来,氧元素非金属性强于S,a正确;b.O和S两元素的简单氢化物受热分解,前者的分解温度高,非金属性越强,氢化物越稳定,因此氧元素非金属性强于硫,b正确;c.氧化性强弱与得到电子的多少没有关系,c错误;答案选ab;(4)金刚石是固体,四氯化碳是液体,所以反应结束冷却至室温后,回收其中的CCl4的实验操作名称为过滤。钠能与水或乙醇反应,除去粗产品中少里钠的试剂为水(或乙醇)。(5)原电池的负极是Al片,正极是铜,硝酸根得到电子,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O;原电池中阳离子向正极移动,则溶液中的H+向正极移动。t1时由于Al在浓HNO3中发生钝化,氧化膜阻止了Al的进一步反应,从而导致原电池中电子流动方向发生改变。


科目:高中化学 来源: 题型:
【题目】FeCl3的用途广泛。
(1)实验室利用FeCl3制备Fe(OH)3胶体:
①Fe(OH)3胶体制备反应的化学方程式为___________________________________________。
②利用所制得的Fe(OH)3胶体进行实验:将其装入U形管内,用石墨作电极,通电一段时间后发现
___________极区附近的红褐色逐渐变深,这表明_________________________________
③向Fe(OH)3胶体中加H2SO4溶液,产生的现象是_______________________________。
(2)FeCl3溶液常用于腐蚀铜印刷电路板,该反应的离子方程式为_________________________。
(3)FeCl3常用于净水,用离子方程式表示其原理____________________________________。
(4)FeCl3溶液中若混有FeCl2,检验FeCl2的试剂为________________________。
(5)将FeCl3溶液蒸干并灼烧得到的固体成分为__________________。
(6)已知Fe(OH)3的Ksp=8×10-38,某溶液中c(FeCl3)=0.05mol/L,如果要使Fe(OH)3沉淀完全,pH至少为______________________。
(溶液中离子浓度小于10-5mol/L认为沉淀已完全,已知lg2=0.3 lg5=0.7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有
A. 3种 B. 4种 C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
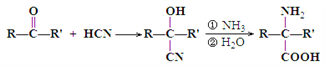
【题目】已知醛或酮可以发生如下反应:
苯丙氨酸(![]() )是合成APM的原料之一。APM的结构简式如图所示。
)是合成APM的原料之一。APM的结构简式如图所示。
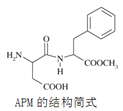
(1)指出APM的结构中含氧官能团的名称__________
(2)下列关于APM的说法中,正确的是_______。
A属于糖类化合物
B分子式为C14H18N2O5
C既能与酸反应,又能与碱反应
D能发生酯化反应,但不能发生加成反应
E 1 molAPM与NaOH反应最终生成1mol H2O
(3)APM在酸性环境水解的产物中,相对分子质量为133的有机物与氨基乙酸(H2N-CH2COOH)以1:1发生反应形成一个含有六元环的化合物。该环状化合物的结构简式为____________________。
(4)苯丙氨酸的一种合成途径如下图所示:
![]()
①烃 A的结构简式为_____________。1 molD完全燃烧消耗O2_______mol.
② 写出C → D反应的化学方程式:________________________________________________.
③ 某苯的同系物苯环上的一硝基取代物只有一种,该硝基取代物W是苯丙氨酸的同分异构体。W的结构简式为__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.苯是一种重要的化工原料,其产品在我们的生活中无处不在。
(1)一定条件下,利用如图所示装置可实现有机物苯(C6H6)到环己烷(C6H12)的转化。
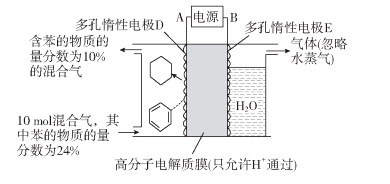
生成目标产物的电极反应式为__________;装置图右侧导出的气体是__________。
(2)已知苯和乙烯可以在催化剂存在的条件下发生加成反应。以苯和乙烯为原料可合成聚苯 乙烯,请设计合成路线(无机试剂及溶剂任选)。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
_________________________________________________________________________
II.丙烯是三大合成材料的基本原料,用于制丙烯腈、环氧丙烷、丙酮、甘油等。下图是以丙烯为原料合成甘油最重要的生产方法。
CH2=CHCH3 ![]() C3H5Cl
C3H5Cl ![]() C3H6OCl2
C3H6OCl2 ![]()
![]()
![]() 甘油
甘油
(3)①的反应类型是:____________
(4)产物C3H6OCl2有两种,选择一种写出反应③的化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
A. 原子序数:Y>X>Z>W B. 离子半径:X+>Y2+>Z->W2-
C. 原子最外层电子数:Z>W>Y>X D. 还原性:X>Y,W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号内为杂质,选项中除杂质的方法正确的是
A. Cu (CuO) 加入稀硝酸溶液,然后过滤洗涤干燥
B. CO2 ( SO2 ) 通过饱和Na2 CO3 溶液
C. CO2 (O2 ) 通过灼热的铜网
D. NO2 (NO) 通过水洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·浙江省温州中学高三3月模拟)以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的![]()
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的![]()
C.加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体,该气体可以使湿润的红色石蕊试纸变蓝,则溶液中一定含有大量的![]()
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com