
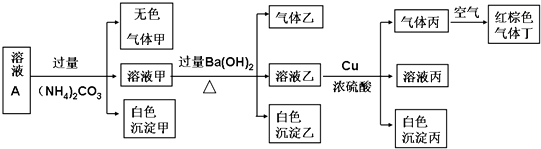
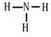
分析 由溶液pH=1可知溶液为酸性溶液,溶液中存在大量氢离子,可以排除CO32-;
溶液A中加过量(NH4)2CO3,产生白色沉淀,白色沉淀只能为氢氧化铝,可以排除Fe2+、Fe3+,溶液含有一定有Al3+;
溶液乙加铜和浓硫酸能产生气体丙,丙在空气中变成红棕色,则丙为NO,原溶液中有NO3-,强酸性溶液中含有NO3-,则一定不存在具有还原性的离子:Fe2+、I-;
铵根离子和氢氧根离子反应生成氨气,氨气分子中每个H原子和N原子共用一对电子;
最后根据电荷守恒得原溶液中含有H+、NO3-、Al3+、SO42-、Cl-五种离子.
解答 解:由溶液pH=1可知溶液为酸性溶液,溶液中存在大量氢离子,可以排除CO32-;
溶液A中加过量(NH4)2CO3,产生白色沉淀,白色沉淀只能为氢氧化铝,可以排除Fe2+、Fe3+,溶液含有一定有Al3+;
溶液乙加铜和浓硫酸能产生气体丙,丙在空气中变成红棕色,则丙为NO,原溶液中有NO3-,强酸性溶液中含有NO3-,则一定不存在具有还原性的离子:Fe2+、I-;
最后根据电荷守恒得原溶液中含有H+、NO3-、Al3+、SO42- Cl-五种离子.
(1)通过以上分析知,溶液A中一定不存在的阴离子有CO32-,故答案为:CO32-;
(2)沉淀甲是铝离子和碳酸根离子的双水解反应生成氢氧化铝沉淀和二氧化碳,生成沉淀乙是钡离子和碳酸根离子、硫酸根离子的反应,二者离子方程式分别为2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑、Ba2++CO32-=BaCO3↓和Ba2++SO42-=BaSO4↓,
故答案为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑;Ba2++CO32-=BaCO3↓和Ba2++SO42-=BaSO4↓;
(3)铵根离子和氢氧根离子反应生成氨气,氨气分子中每个H原子和N原子之间共用一对电子,其结构式为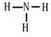 ,故答案为:
,故答案为: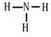 ;
;
(4)酸性条件下,铜和硝酸根离子发生氧化还原反应生成铜离子和NO,离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据转移电子守恒得V(NO)=$\frac{\frac{144g}{64g/mol}×2}{3}$×22.4L/mol=33.6L,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;33.6L.
点评 本题考查物质检验实验方案设计,为高频考点,明确离子性质及离子之间反应是解本题关键,根据某些物质特殊性进行推断,熟练掌握转移电子守恒的有关计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
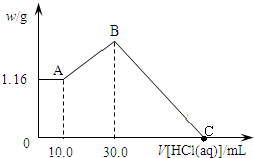
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
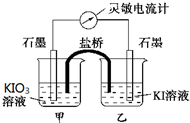 将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )
将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )| A. | 两次电流计指针偏转方向相反,电流计读数为零时,反应达到化学平衡状态 | |
| B. | 两次实验中,盐桥中的阳离子移动方向相反 | |
| C. | 开始加入少量浓硫酸时,只有乙烧杯中溶液变蓝 | |
| D. | 向甲烧杯中滴入几滴浓NaOH溶液后,乙中石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+ NH4+ Fe2+ Mg2+ Al3+ Cu2+ |
| 阴离子 | OH- Cl- Al02- CO32- SiO32-SO42- |
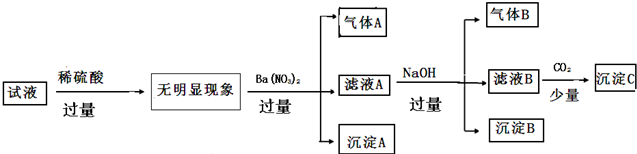
| A. | 原溶液中只含有NH4+ Fe2+Cl- SO42- | |
| B. | 由沉淀A推断原溶液中一定含有SO42- | |
| C. | 滤液A中可能含有K+ Al3+ Cl- | |
| D. | 沉淀B中一定含有Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3 | B. | +1 | C. | +4 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | NaNO3 | C. | Mg(NO3)2 | D. | Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、H+、SO42- | B. | H+、NO3-、Ba2+、Cl- | ||
| C. | K+、Cl-、H+、SO42- | D. | Ca2+、Na+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com