
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
【答案】100mL容量瓶 20.0mL cde 取上层清液,继续滴加BaCl2溶液,若无明显沉淀,说明硫酸根离子已经沉淀完全 大于
【解析】
(1)依据配制溶液体积选择合适规格容量瓶;
(2)依据c=![]() 计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积;
计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积;
(3)根据c= ![]() 分析;
分析;
(4)要证明溶液中的硫酸根离子沉淀完全:取上层清液,继续滴加BaCl2溶液,若无明显沉淀,说明硫酸根离子已经沉淀完全;
(5)根据质量分数的定义式计算。
(1)配制3.6mol·L-1的H2SO4溶液80mL,应选择100mL容量瓶;
(2)选用98%的硫酸 (ρ=1.8g·mL-1),物质的量浓度c=![]() =18mol·L-1,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:18mol·L-1×V=3.6mol·L-1×100mL,解得V=20.0mL;
=18mol·L-1,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:18mol·L-1×V=3.6mol·L-1×100mL,解得V=20.0mL;
(3)a.量取硫酸溶液的量筒未用蒸馏水洗涤,不影响溶质的物质的量,故a不选;
b.硫酸稀释后立即转移至容量瓶中,冷却后,使溶液的体积偏小,浓度偏大,故不选;
c.转移的时候不小心有少许洒到实验台上,n偏小,则浓度偏小,故选;
d.定容摇匀时,液面下降,又加水至刻度线,相当于多加了水,溶液的体积偏大,浓度偏小,故选;
e.定容时仰视刻度线,相当于多加了水,溶液的体积偏大,浓度偏小,故选;
故选cde;
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。要证明溶液中的硫酸根离子沉淀完全:取上层清液,继续滴加BaCl2溶液,若无明显沉淀,说明硫酸根离子已经沉淀完全;
(5)将100mL标号为②的浓硫酸与水(密度为1g/mL)混合,其质量分数为49﹪,设水的体
积VmL,![]() ×100%=49%,,V=180mL,故V>100mL。
×100%=49%,,V=180mL,故V>100mL。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用如图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A.棉花球处发生的离子反应是Cl2+H2O = H++Cl-+HClO
B.大量白烟是氯化钠固体小颗粒
C.钠着火燃烧产生黄色火焰
D.可在棉花球右侧用湿润的淀粉KI试纸判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
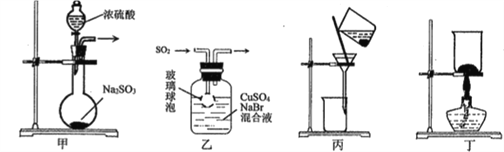
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
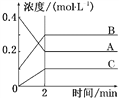
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.1mol![]() 气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法错误的是
气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法错误的是
A. 压缩容器,颜色加深
B. 在平衡时体系内含![]() 0.04mol
0.04mol
C. 以![]() 的浓度变化表示的平均反应速率为0.001mol/(L·s)
的浓度变化表示的平均反应速率为0.001mol/(L·s)
D. 平衡时,如果再充入一定量![]() ,则可提高
,则可提高![]() 的转化率
的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向NaOH溶液中通入过量CO2:2OH-+CO2===![]() +H2O
+H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 向H2O2溶液中滴加MnO2:2H2O2+4H++MnO2===O2↑+Mn2++4H2O
D. 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至![]() 沉淀完全:Al3++2
沉淀完全:Al3++2![]() +2Ba2++4OH-===
+2Ba2++4OH-===![]() +2BaSO4↓+2H2O
+2BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com