
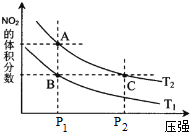
| c(H2)c(CO) |
| c(H2O) |
| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| c2(CO) |
| c(CO2) |
| c(H2)?c(CO2) |
| C(CO)?C(H2O) |
| c(CO)?c(H2) |
| c(H2O) |
| c×c |
| (0.02-c)(0.02-c) |
| 0.015mol/L |
| 0.02mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、2NaOH+H2SO4═Na2SO4+2H2O |
| B、Ba(OH)2+H2SO4═Ba SO4↓+2H2O |
| C、KOH+HCl═KCl+H2O |
| D、Cu(OH)2+2HNO3═Cu(NO3)2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝是地壳里含量最多的金属元素 |
| B、在常温下,铝不能与氧气反应 |
| C、铝是一种比较活泼的金属 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
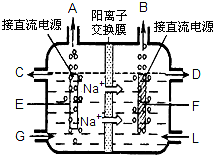 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
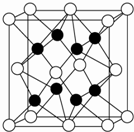 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com