
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 用Pt电极电解氯化铝溶液:2Cl-+2 H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2+2OH- | |
| D. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O |
分析 A.氢氧化铁比氢氧化镁更难溶,实现了沉淀的转化;
B.与电源负极相连的为电解池的阴极,发生还原反应,铜离子得到电子生成铜;
C.生成的氢氧根离子与铝离子反应生成氢氧化铝沉淀;
D.镁不与氢氧化钠溶液反应,则负极为Al失去电子生成铝离子,铝离子与氢氧根离子反应生成偏铝酸根离子.
解答 解:A.向FeCl3溶液中加入Mg(OH)2,氢氧化镁沉淀转化成更难溶的氢氧化铁沉淀,反应的离子方程式为:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故A正确;
B.粗铜精炼时,与电源负极相连的纯铜为阴极,阴极铜离子得到电子生成金属铜,电极反应式为:Cu2++2e-═Cu,故B正确;
C.用Pt电极电解氯化铝溶液,铝离子与氢氧根离子反应生成氢氧化铝,正确的离子方程式为:2Al3++2Cl-+6H2O$\frac{\underline{\;电解\;}}{\;}$3Cl2↑+3H2+2Al(OH)3↓,故C错误;
D.Mg、Al、NaOH溶液组成原电池,Mg不与NaOH溶液反应,则负极为Al,负极反应式为:Al-3e-+4OH-═AlO2-+2H2O,故D正确;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 银制奖牌久置后表面变暗镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 镀锌的铁比镀锡的铁耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部形成AlO2- | B. | 全都为Al(OH)3 | ||
| C. | 一部分为Al(OH)3,一部分为Al3+ | D. | 一部分为Al(OH)3,一部分为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe3++Cu | |
| B. | NaHSO4溶液与氢氧化钠溶液反应:OH-+H+═H2O | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定含Cu2+和Fe2+ | B. | 溶液中一定含Cu2+和Fe3+ | ||
| C. | 溶液中一定含 Fe3+和Fe2+ | D. | 溶液中一定含Fe3+、Cu2+和Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镊子夹取钠块,吸干表面的煤油后,用小刀切下一部分进行实验.剩余的钠应放回原试剂瓶 | |
| B. | 钠加热后先熔化成小球状,这是因为金属钠的熔点较低 | |
| C. | 钠燃烧时火焰呈黄色,这与钠元素的焰色反应有关 | |
| D. | 钠块表面若有部分已被氧化为Na2O,充分燃烧后将得到Na2O和Na2O2的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X为氧气 | |
| B. | 电极A反应式:CH3CH2OH-12e-+3H2O═2CO2+12H+ | |
| C. | 电极材料活泼性:A>B | |
| D. | B电极附近溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
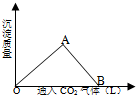 (1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com